皮下注射PD-L1抗体美国1期临床数据发表|The Oncologist
收藏
关键词:
临床数据注射临床期临床抗体
资讯来源:医药观澜 + 订阅账号
发布时间:
2021-05-29
5月28日消息,康宁杰瑞、思路迪医药与先声药业战略合作的一款重组人源化PD-L1单域抗体(恩沃利单抗,KN035),于国际知名医学期刊The Oncologist在线全文发表一项美国1期临床试验数据。研究者认为,在有既往治疗史的晚期实体瘤患者中,恩沃利单抗耐受性良好,在不同的给药方案下均表现出持久的抗肿瘤活性。
根据新闻稿,恩沃利单抗注射液为康宁杰瑞研发的PD-L1单域抗体Fc融合蛋白,由思路迪医药负责肿瘤领域的临床开发,先声药业负责在中国大陆的独家商业化推广。
基于恩沃利单抗独特设计,在安全性、便利性、依从性方面具有优势,且患者无需进行静脉滴注。
2020年11月,恩沃利单抗向中国药品监督管理局(NMPA)提交新药上市申请
,适应症包括既往标准治疗失败的微卫星不稳定(MSI-H)/错配修复功能缺陷(dMMR)晚期结直肠癌、胃癌及其他晚期实体瘤,并被纳入
,有望在不久的将来为患者带来新的治疗方案。
此次在线发表的是一项恩沃利单抗首次进行人体1期临床试验,适应症为晚期实体瘤。试验启动于2017年2月,研究包括剂量递增和剂量探索两个阶段。在剂量递增阶段,18例受试者通过改良的3+3方法接受0.01-10 mg/kg 每周一次(QW)皮下注射给药。在剂量探索阶段,10例受试者接受 300 mg 每4周一次(Q4W)皮下注射给药。
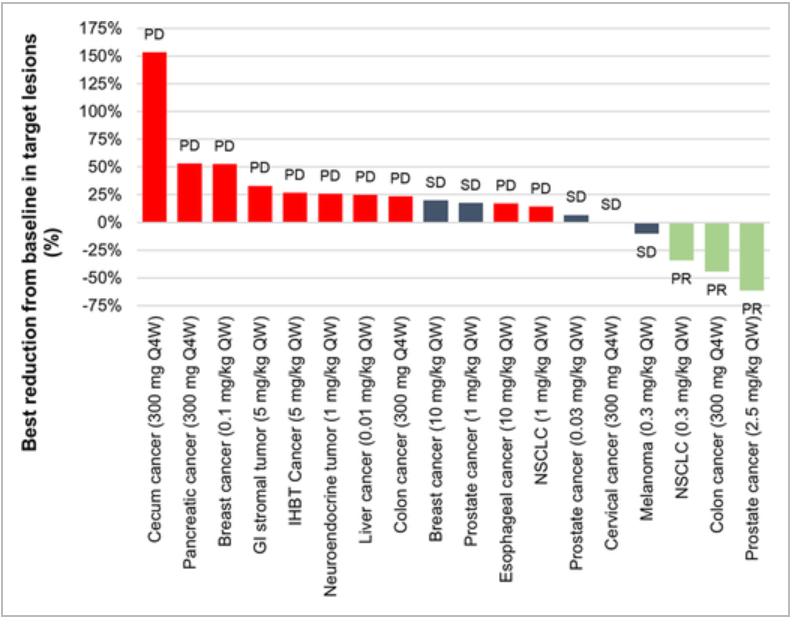
▲
研究观察到的肿瘤反应(截图来源:参考资料[2])
试验结果显示,共3例受试者获得经确认的部分缓解,低至0.3 mg/kg QW即可观察到疗效应答,缓解时间持久
。截至数据截止日期,有2例仍在继续缓解中。
在剂量递增阶段
,未观察到剂量限制性毒性,也未达到最大耐受剂量
,所有28例受试者均未出现注射部位反应或输注反应。恩沃利单抗在剂量递增阶段表现出良好的药代动力学特征,剂量-暴露关系呈比例增加。
在剂量探索阶段
,采用300 mg Q4W时,稳态半衰期可长达23天。药代动力学模拟结果支持对300 mg Q3W或400 mg Q4W的固定剂量给药方案进行临床开发,预期能为肿瘤患者提供更为便捷的治疗选择。
在安全性方面,
最常见的治疗紧急不良事件为疲劳(29%)、恶心(18%)、腹泻(14%)和甲状腺功能减退(14%)。没有关于≥4级药物相关的治疗紧急不良事件,未观察到剂量限制性毒性(DLT)或注射部位反应的报道。
根据文章作者描述,这项1期临床试验结果表明,在以往接受过治疗的晚期实体瘤患者中,恩沃利单抗在各种剂量和方案下均具有持久的抗肿瘤活性。恩沃利单抗皮下注射是一种有效的给药途径,具有良好的耐受性,有望成为当前获批的多种PD-L1抗体静脉给药剂型以外,更方便患者使用的新选择。
注:本文旨在介绍医药健康研究进展,不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。
[1]
恩沃利单抗美国Ⅰ期临床数据发表在《The Oncologist》杂志. Retreved May 28, 2021, from https://mp.weixin.qq.com/s/IWR1RLzzxbVxjbqgcUUwRQ
[2]First-in-Human Phase I Study of Envafolimab, a Novel Subcutaneous Single-Domain Anti-PD-L1 Antibody, in Patients with Advanced Solid Tumors . Retreved May 11, 2021, from https://theoncologist.onlinelibrary.wiley.com/doi/full/10.1002/onco.13817
声明:本文由药明康德内容团队根据公开资料整理编辑,欢迎个人转发至朋友圈,谢绝媒体或机构未经授权以任何形式转发/复制至其他平台。转发授权请在「医药观澜」微信公众号留言联系我们。




 药选址
药选址

