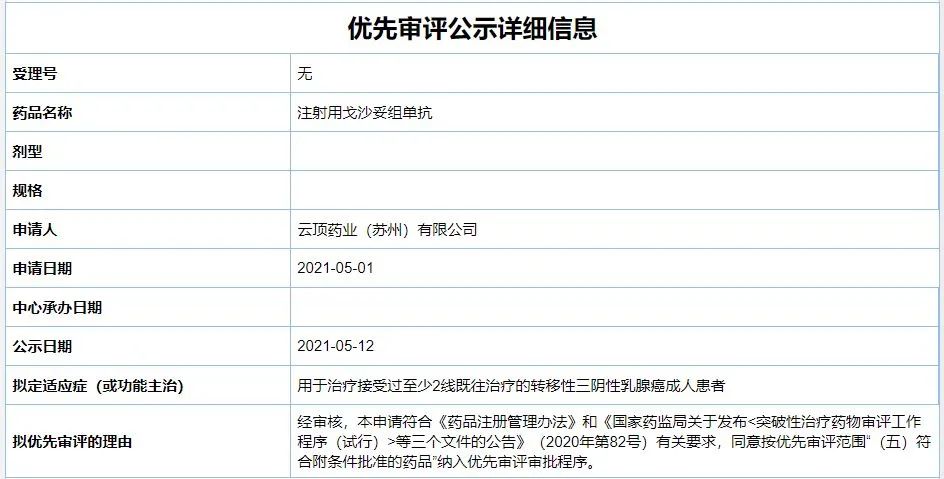
5月12日,中国国家药品监督管理局药品审评中心(CDE)公示显示,云顶新耀引进的注射用戈沙妥组单抗已被纳入拟优先审评名单,针对的适应症为三阴性乳腺癌。公开资料显示,戈沙妥组单抗是全球首款获得监管机构批准的靶向TROP-2的抗体偶联药物(ADC) ,该药已在美国获批治疗三阴性乳腺癌、尿路上皮癌。

截图来源:CDE官网
TROP-2全称为人滋养细胞表面抗原。研究发现,TROP-2在各种人类上皮癌中高度表达,包括乳腺癌、肺癌、胃癌、结肠直肠癌、胰腺癌、前列腺癌、宫颈癌、头颈癌和卵巢癌等。TROP-2的过表达在肿瘤生长过程中起着关键作用。此外,在乳腺癌等几种癌症中,TROP-2的高表达还被发现与更具侵袭性的疾病和预后不良相关。
戈沙妥组单抗(sacituzumab govitecan-hziy)是一款将靶向TROP-2的抗体与化疗药物伊利替康的活性代谢物SN-38连接构成的ADC,是吉利德科学(Gilead Sciences)通过收购Immunomedics公司所得。云顶新耀拥有其所有癌症适应症在大中华区、韩国和部分东南亚国家的研发、注册和商业化独家权利。
在美国,戈沙妥组单抗于2020年4月首次获得FDA加速批准,用于治疗转移性三阴性乳腺癌患者,成为了首款获批上市的靶向TROP-2的ADC。2021年4月,FDA已
戈沙妥组单抗用于治疗转移性三阴性乳腺癌患者,并批准其用于治疗局部晚期或转移性
患者的新适应症。
CDE公示信息显示,戈沙妥组单抗本次因“符合附条件批准的药品”被纳入拟优先审评,拟用于治疗接受过至少2线既往治疗的转移性三阴性乳腺癌成人患者。
根据戈沙妥组单抗获得FDA完全批准的数据,在一项名为ASCENT的3期临床试验中,戈沙妥组单抗组患者的中位总生存期(OS)为11.8个月(VS 化疗组6.9个月),与化疗组相比,将患者死亡风险降低了49%。此外,戈沙妥组单抗组还将患者的疾病进展或死亡风险降低了57%。
目前,云顶新耀正在多个国家和地区对戈沙妥组单抗进行开发。2021年1月,云顶新耀宣布已向新加坡提交戈沙妥组单抗的新药上市申请。5月6日,云顶新耀还宣布,戈沙妥组单抗已获得了韩国食品医药品安全部(MFDS)授予的孤儿药资格。此外,戈沙妥组单抗也正在中国进行针对尿路上皮癌的3期临床试验。
期待云顶新耀戈沙妥组单抗的后续研究顺利进行,早日获批,为患者带来新的治疗选择。
注:本文旨在介绍医药健康研究进展,不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。
[1]中国国家药监局药品审评中心. Retrieved May 12, 2021, from http://www.cde.org.cn/news.do?method=changePage&pageName=service&frameStr=25#
[2] 国家药监局药品审评中心公示注射用戈沙妥组单抗为拟优先审评品种. Retrieved May 12, 2021, from https://mp.weixin.qq.com/s/gPC7oQE-zda8x0JaBX2nng
版权说明:本文来自药明康德内容团队,欢迎个人转发至朋友圈,谢绝媒体或机构未经授权以任何形式转载至其他平台。转载授权请在「医药观澜」微信公众号留言联系我们。








 个人中心
个人中心
 我是园区
我是园区




