
五羟色胺转运蛋白(serotonin transporter: SERT)是神经递质钠同向转运蛋白 (neurotransmitter sodium sympoter: NSS) 家族的成员,是治疗重度抑郁症和焦虑症的药物靶点。除了传统的中心位点(S1)外,研究人员发现在SERT的细胞外暴露区域还有第二个小分子结合位点,称为变构结合位点(S2)。S2可以结合丙咪嗪(imipramine)和西酞普兰(citalopram)等抗抑郁药或五羟色胺(5-HT),并减缓小分子配体从中心位点的解离。然而SERT如何与内源底物5-HT 结合并将其从突触间隙转运到突触前膜的细胞质内的分子机制尚不清楚。在过去几十年中,底物变构位点的存在以及对NSS变构调节的理解一直是一个有争议的话题。
目前有超过 2.5 亿人承受着抑郁症的折磨,抑郁症已经成为一个世界性的问题。随着 COVID-19 大流行的到来,预计这一数字还会进一步上升。抑郁症的主要治疗药物是选择性五羟色胺再摄取抑制剂 (selective 5-HT reuptake inhibitors:SSRIs),它们通过阻断SERT转运5-HT来发挥作用。目前已知的SSRIs都通过与SERT的S1竞争性结合来阻断SERT的转运活性。而结合在S2的非竞争性抑制剂在治疗功效和副作用方面具有独特的临床特征以及优势。俄勒冈健康科学大学的Eric Gouaux 研究团队对SERT进行了广泛的研究,揭示了SERT的转运机制并解析了不同抗抑郁药的抑制机制。Eric Gouaux 研究团队率先解析了SERT与抗抑郁药citalopram复合物的晶体结构,发现citalopram同时占据中心位点S1以及变构位点S2(Nature,2016)。与S2位点结合的citalopram能够减缓citalopram从S1位点的解离。最近,Eric Gouaux 研究团队与哥本哈根大学的Claus J Loland研究团队合作,阐明了SERT与FDA批准的临床抗抑郁药维拉佐酮(vilazodone)以及另一种中心位点结合的三环抗抑郁药imipramine复合物的结构(Nat commun,2021)。揭示了vilazodone以近乎线性的姿势横跨在SERT的细胞外前庭,结合在S2位点。Vilazodone的S2位点仅与citalopram结合的S2位点部分重叠,并延伸到一个新的结合区域,在 SERT 中定义了一个新的小分子结合位点。
2021年12月1日,Science Advances杂志在线发表了Eric Gouaux研究团队的研究论文,题为Illumination of serotonin transporter mechanism and role of the allosteric site (第一作者:杨冬雪博士),揭示了底物(5-HT)的一个新的、可成药的变构结合位点,展示了5-HT如何有效地通过一个tunnel从变构位点转移到中心位点,并首次提供变构调节的结构基础,展示了SERT如何结合突触间隙的5-HT并将其转运到突触前神经元细胞质内。

由于SERT是一种相对较小的膜蛋白,其结构域几乎全部埋在细胞膜中,因此作者将SERT 重组到nanodiscs中,并使用特异性抗体来增加膜外区域的分子特征,协助高分辨率单颗粒冷冻电镜的重构。作者首先解析了5HT-SERT复合物在NaCl中的冷冻电镜结构,通过3D分类发现SERT主要有两种构象:向细胞外开放构象以及部分关闭构象;而在KCl中,5-HT-SERT则处于向细胞内开放的构象。作者在三种构象的S1位点都观察到5-HT的密度,5-HT 与中心部位“松散”结合,没有完全占据中心结合口袋,与周围氨基酸有一定的空间距离,因此作者推测如果在5-HT上增加甲基的修饰,这些类似物应该仍然能够结合SERT,并且由于增大了分子,填满了具有疏水环境的结合口袋,他们与SERT的结合能力也会增强,作者通过与[3H]-paroxetine的竞争结合试验验证了这一假设。三种5-HT甲基类似物具有比5-HT高2-4 倍的结合力。同时作者发现N-甲基吲哚衍生物也是SERT的底物,能够被SERT转运,这也进一步验证了中心结合口袋的“空间特征”,可能也是SERT识别多种底物的基础。
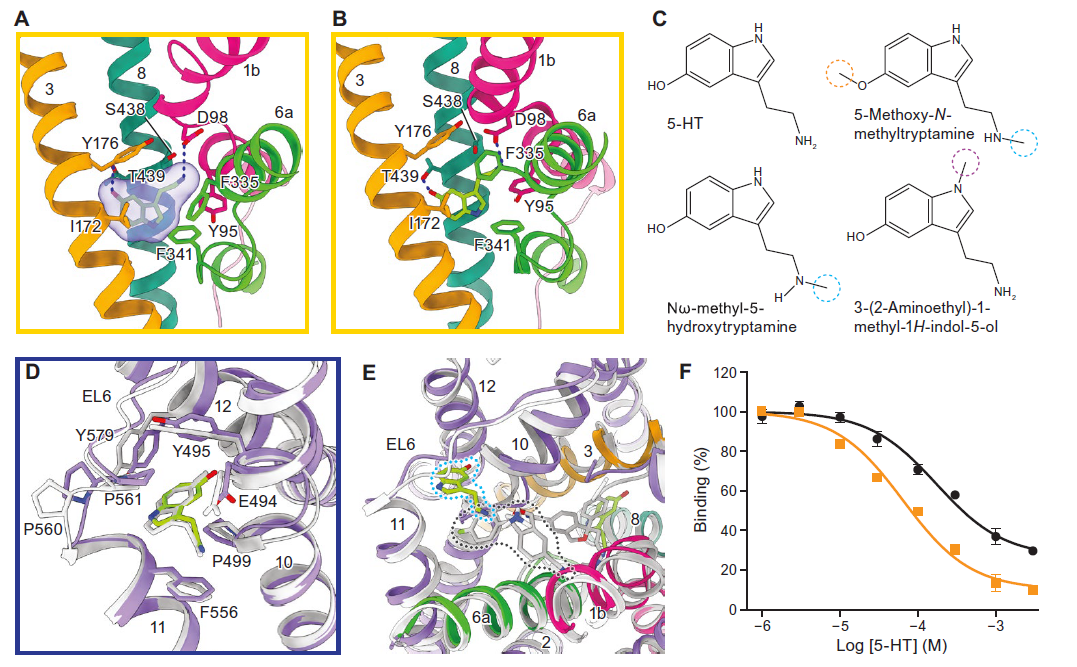
最重要的是作者找到了一直以来备受关注的底物变构结合位点,该位点是位于细胞外前庭的一个疏水口袋,主要由scaffold domain的TM10-12以及EL6组成。和抗抑郁药变构结合位点相比,作者发现两个结合位点并不重合,抗抑郁药变构结合位点位于从胞外进入中心位点的通路上,抗抑郁药与该位点的结合会阻断与中心位点结合的配体的解离,同时抑制SERT细胞外门的关闭。而底物5-HT的变构结合位点是位于抗抑郁药变构结合位点旁边的疏水口袋,这个口袋很小仅能够容纳像5-HT大小的小分子,5-HT在该位点的结合不会影响SERT细胞外门的关闭与打开。整个底物5-HT变构结合位点在SERT的构象变化过程中一直保持完整。进一步研究向细胞外开放、部分关闭和向细胞内开放三种构象中的两个5-HT 结合位点,作者发现当SERT处于向细胞外开放的构象,有一条tunnel连接5-HT变构结合位点和中心位点。因此,底物5-HT可以从细胞外溶液或变构位点进入中心位点,同时也揭示了具有两个底物结合位点的转运蛋白是如何结合并转运底物的。
作者同时解析了不同离子条件下apo SERT的结构。在KCl中,apo SERT处于向细胞内开放构象。而在NaCl中,apo SERT具有两种构象:部分关闭和向细胞内开放的构象,这种不均一的构象表明,在钠离子存在时,SERT可能处于多种构象的动态平衡,可能也包括向细胞外开放的构象。
总结来说,这些转运周期中的SERT不同构象的变化,揭示了5-HT是如何从胞外被转运到细胞质内的结构机制:当SERT处于向细胞外开放构象时,钠离子和氯离子首先与SERT结合,然后内源底物5-HT分别结合到S1位点和S2位点,转运过程启动,经过部分关闭和向细胞内开放的中间构象,随着内门打开,中心位点结合的5-HT被释放到细胞质内;而底物变构结合位点,如果结合5-HT,会保持结合5-HT不释放,然后SERT再次循环回到向细胞外开放构象,一旦SERT细胞外门打开,中心位点可以重新结合5-HT,5-HT既可以从细胞外溶液进入到中心位点,也可以直接从变构位点转移到中心位点,启动新一轮的5-HT转运过程。

5-HT转运机制
本研究的通讯单位为俄勒冈健康科学大学,Eric Gouaux教授是本文的通讯作者,杨冬雪博士为本文的第一作者。
转载须知
【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经允许禁止转载,作者拥有所有法定权利,违者必究。




 个人中心
个人中心
 我是园区
我是园区




