▎药明康德内容团队报道
6月6日,中国国家药监局药品审评中心(CDE)官网公示,安进(Amgen)和百济神州联合申报的1类新药AMG 509获得临床试验默示许可,拟开发用于治疗转移性去势抵抗性前列腺癌。公开资料显示,这是一款可同时靶向STEAP1和CD3的双特异性T细胞结合器,目前正在海外开展治疗去势抵抗性前列腺癌的1期临床试验。

STEAP1(前列腺跨膜上皮抗原1)是一种由雄激素诱导并在前列腺癌中高表达的细胞表面抗原。STEAP1在尤因肉瘤(EWS)中也高度表达,并且受到EWS-FLI1融合蛋白的调控,EWS-FLI1融合是该恶性肿瘤的主要致癌驱动因素。CD3是效应T细胞上的受体,也是T细胞表面的重要标志。通过CD3介导T细胞特异性攻击肿瘤细胞,是T细胞导向的双特异性抗体的主要作用机制。
公开资料显示,AMG 509是一种新型人源化双特异性T细胞募集抗体,能与人、灵长类动物的STEAP1抗原和T细胞表面的CD3受体结合。在结构设计上,安进利用了Xencor公司的Xmab 2+1非对称技术,并且延长了这一蛋白的半衰期。此前,AMG 509已经在研究中表现出显著降低患者前列腺特异性抗原(PSA)水平的活性,它还曾获得美国FDA授予治疗尤因肉瘤的孤儿药资格。根据百济神州官网资料介绍,AMG 509是其与安进合作研发的管线之一,百济神州拥有中国商业化权益。
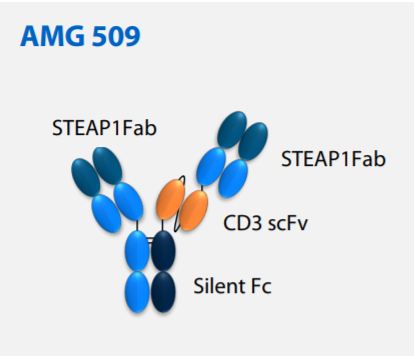
▲AMG 509分子模型(截图来源:参考资料[2])
根据ClinicalTrials网站,目前AMG 509正在开展一项治疗转移性去势抵抗性前列腺癌患者的1期临床试验,目的是评估候选药在成年受试者中的安全性和耐受性,并确定最大耐受剂量(MTD)和2期推荐剂量(RP2D)。
前列腺癌是全球男性常确诊的恶性肿瘤之一。大多数男性在确诊时患有局部前列腺癌,可通过手术或放疗进行治疗。前列腺癌细胞的生长具有雄激素依赖性,故患者最初对雄激素剥夺治疗(ADT)敏感,而经持续ADT后仍然发生疾病进展的患者会发展为转移性去势抵抗性前列腺癌(mCRPC)。据预估,有10%~20%的前列腺癌患者会于确诊后5~7年内发展成为mCRPC。靶向STEAP1和CD3的双特异性T细胞结合器有望为这类患者带来一种新的治疗选择。
参考资料:
[1]中国国家药监局药审中心官网. Retrieved Jun 6, 2023, from https://www.cde.org.cn/main/xxgk/listpage/2f78f372d351c6851af7431c7710a731
[2] Amgen Business Review Meeting. Retrieved February 8, 2022, from https://investors.amgen.com/static-files/6d823d7d-2fd1-405a-8c0e-22aa91bee682
本文来自药明康德内容团队,欢迎个人转发至朋友圈,谢绝媒体或机构未经授权以任何形式转载至其他平台。转载授权请在「医药观澜」微信公众号留言联系我们。其他合作需求,请联系wuxi_media@wuxiapptec.com。
免责声明:药明康德内容团队专注介绍全球生物医药健康研究进展。本文仅作信息交流之目的,文中观点不代表药明康德立场,亦不代表药明康德支持或反对文中观点。本文也不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。




 个人中心
个人中心
 我是园区
我是园区




