
阿尔茨海默病
(Alzheimer’s disease,简称
AD
)
是老年人群中最为常见,以渐进性认知功能障碍和行为损害为特征的神经退行性疾病。AD的两个典型病理特征分别是脑中主要由淀粉样蛋白-β
(Amyloid-β, Aβ)
纤维化沉积形成的淀粉样斑块和神经细胞内Tau蛋白过度磷酸化导致的神经纤维缠结。目前,AD尚缺乏切实有效的治疗药物,随着寿命的延长和社会老龄化加剧,AD将是一个亟待解决的公共医疗问题。
小胶质细胞
(Microglia)
是中枢神经系统的常驻固有免疫细胞,在维持大脑稳态、大脑发育以及神经退行性病理过程中起着重要作用。近年来,全基因组关联研究发现,许多AD风险基因座
(Risk loci)
在小胶质细胞中独有或在其高度表达,提示小胶质细胞与AD病理变化密切相关,甚至可挖掘重要的潜在AD治疗靶点
【1】
。小胶质细胞可通过其表面受体与淀粉样斑块中Aβ等化学组分结合,从而触发小胶质细胞响应,吞噬清除Aβ淀粉样斑块
【2】
。虽有研究表明体外纤维化的Aβ具有超强的硬度
【3】
,但体内Aβ淀粉样斑块如何改变与之镶嵌的局部脑组织硬度并不清楚。小胶质细胞具有趋硬特性
(Durotaxis)
【4】
,但小胶质细胞如何识别淀粉样斑块带来的物理性变化,如何因应激活以及如何最终影响AD病理进程,这些都是AD研究领域仍有待解答的问题。
2022年11月10日,厦门大学细胞应激生物学国家重点实验室、厦大生科院、厦大医学院神经科学系莫玮教授团队在Neuron杂志上发表了题为
Microglial Piezo1 senses Aβ fibrils stiffness to restrict Alzheimer’s disease
的研究成果,
揭示了小胶质细胞通过机械力受体Piezo1感知纤维化Aβ硬度而激活,并显著改善AD相关病理变化。
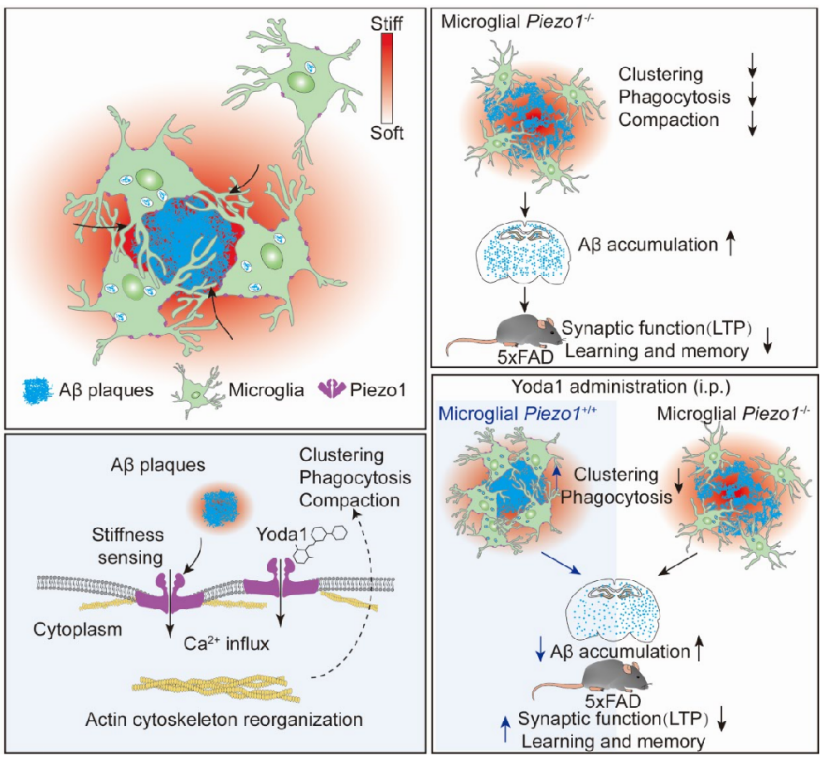
在该研究中,研究者利用Methoxy-X04在体标记脑中Aβ淀粉样斑块并结合原子力显微镜技术,明确了新鲜活体脑片中Aβ淀粉样斑块相关组织的硬度显著高于非Aβ淀粉样斑块相关组织。细胞对硬度等机械力刺激的感知,通常需要机械敏感的离子通道蛋白
【5】
。研究者分析了已有报道的几种机械力感知蛋白在小胶质细胞中的表达情况,发现其中Piezo1在小胶质细胞中相对其他机械通道蛋白表达最高。同时在体外原代培养小胶质细胞中,受纤维化Aβ硬度刺激,小胶质细胞Piezo1蛋白表达增高,并进一步通过钙影像和细胞电生理实验明确了小胶质细胞通过Piezo1感知纤维化Aβ硬度并产生下游电化学信号。
在Piezo1P1-tdT; 5×FAD小鼠模型和AD病人脑切片样本中,研究者发现,Piezo1高表达于淀粉样斑块周围小胶质细胞中。当在5×FAD小鼠中特异敲除小胶质细胞Piezo1之后,小鼠脑中Aβ淀粉样斑块显著增多、突触功能减弱及记忆认知功能障碍加重。体内体外实验均表明,Piezo1敲除或敲降后,显著降低了小胶质细胞吞噬功能。在5×FAD小鼠中,研究者利用成年小鼠小胶质细胞流式分选联合RNA测序分析发现,小胶质细胞特异敲除Piezo1后显著下调基因主要涉及细胞骨架蛋白、Rho蛋白、整合素等与细胞机械信号传递、细胞迁移等作用密切相关的信号通路。与之对应,小胶质细胞Piezo1敲除后,迁移到淀粉样斑块的小胶质细胞数目减少,对斑块包裹程度减少,导致淀粉样斑块更加趋向松散。最后在5×FAD小鼠中,研究者通过腹腔注射给予Piezo1特异激动剂Yoda1后显著提高了小胶质细胞在淀粉样斑块周边的聚集和对Aβ的内吞,减少了Aβ在小鼠脑中的累积,明显改善了5×FAD小鼠的认知功能障碍。然而,当5×FAD小鼠敲除小胶质细胞Piezo1后,Yoda1给药不再具有改善Aβ相关病理作用,表明Yoda1 在AD小鼠中对Aβ相关表型的缓解作用依赖于小胶质细胞Piezo1的激活。
综上所述,
本研究从机械力生物学角度揭示了小胶质细胞Piezo1介导的信号传导在AD病理过程中的保护作用,拓宽了小胶质细胞与AD病理进程紧密相关的认识,也为AD的药物研发提供了潜在的新靶点。
该论文的第一作者兼共同通讯作者为胡进博士;博士生陈强、硕士生朱泓瑞
(已毕业,目前工作于中国科学技术大学附属第一医院)
以及厦门大学附属翔安医院麻醉科侯立朝主任为本文共同第一作者。莫玮教授和张亮教授为本文共同通讯作者。特别感谢国家健康和疾病人脑组织资源库为本研究提供AD人脑组织样本。
莫玮实验室主要方向为细胞应激和细胞死亡,欢迎具有免疫或神经环路背景的博士加盟。
原文链接:
https://doi.org/10.1016/j.neuron.2022.10.021
制版人:十一
1. Lopes, K.P., Snijders, G.J.L., Humphrey, J., Allan, A., Sneeboer, M.A.M., Navarro, E., Schilder, B.M., Vialle, R.A., Parks, M., Missall, R., et al. (2022). Genetic analysis of the human microglial transcriptome across brain regions, aging and disease pathologies. Nat Genet 54, 4-17. 10.1038/s41588-021-00976-y.
2. Zhao, Y., Wu, X., Li, X., Jiang, L.L., Gui, X., Liu, Y., Sun, Y., Zhu, B., Pina-Crespo, J.C., Zhang, M., et al. (2018). TREM2 Is a Receptor for beta-Amyloid that Mediates Microglial Function. Neuron 97, 1023-1031 e1027. 10.1016/j.neuron.2018.01.031.
3. Xu, Z., Paparcone, R., and Buehler, M.J. (2010). Alzheimer's abeta(1-40) amyloid fibrils feature size-dependent mechanical properties. Biophys J 98, 2053-2062. 10.1016/j.bpj.2009.12.4317.
4. Bollmann, L., Koser, D.E., Shahapure, R., Gautier, H.O., Holzapfel, G.A., Scarcelli, G., Gather, M.C., Ulbricht, E., and Franze, K. (2015). Microglia mechanics: immune activation alters traction forces and durotaxis. Front Cell Neurosci 9, 363. 10.3389/fncel.2015.00363.
5. Delmas, P., Hao, J., and Rodat-Despoix, L. (2011). Molecular mechanisms of mechanotransduction in mammalian sensory neurons. Nat Rev Neurosci 12, 139-153. 10.1038/nrn2993.

【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经作者的允许禁止转载,作者拥有所有法定权利,违者必究。











 个人中心
个人中心
 我是园区
我是园区





