转自:药品审评中心 整理:蒲公英-绿茶
2016年2月6日国务院办公厅发布“关于开展仿制药质量和疗效一致性评价的意见”明确提出通过一致性评价的药品品种,同品种药品通过一致性评价的生产企业达到3家以上的,在药品集中采购等方面不再选用未通过一致性评价的品种。2016年5月25日,国家食药监总局发布“关于落实《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》有关事项的公告”,明确289个品种必须于2018年年底前完成一致性评价的化学药品仿制药口服固体制剂品种及其相应的规格;两条通知将制药人的目光聚焦口服固体制剂。
2020年5月,国家药监局发布《关于开展化学药品注射剂仿制药质量和疗效一致性评价工作的公告》,正式启动注射剂一致性评价工作;政策的顺利推进,为第四次带量集采打好实施的基础,也将影响千亿级别的注射剂市场。
2017年9月 一致性评价工作启动;
2017-2019年 以口服固体制剂为主;
2020年 重点围绕注射剂开展。
2020年5月,国家药监局发布《关于开展化学药品注射剂仿制药质量和疗效一致性评价工作的公告》。
药审中心3个技术文件和1个工作方案:
《化学药品注射剂仿制药质量和疗效一致性评价技术要求》;
《化学药品注射剂(特殊注射剂)仿制药质量和疗效一致性评价技术要求》;
《化学药品注射剂仿制药质量和疗效一致性评价申报资料要求》;
《化学仿制药注射剂一致性评价工作方案》。
对临床价值明确但无法确定参比制剂的化学药品注射剂仿制药,如氯化钠注射液、葡萄糖注射液、葡萄糖氯化钠注射液、注射用水等,无须开展一致性评价,但鼓励持有人按照相关指导原则开展药品质量提升相关研究。
据统计,截至2020年底,累计通过和视同通过一致性评价审评的品种已达445个,约占常用化学药品的三分之一。包括口服固体制剂321个;注射剂86个,其中包括抗感染药物、消化系统及循环系统疾病用药等临床常用药;其他剂型38个。

自2018年11月国家启动“4+7”药品集采试点以来,短短两年时间,药品集采从试点到全国扩围,并逐步进入常态化制度化运作。
在前三批全国药品集采中分别有25、33、55个品种的药品中选;第四批集采纳入了45个品种。
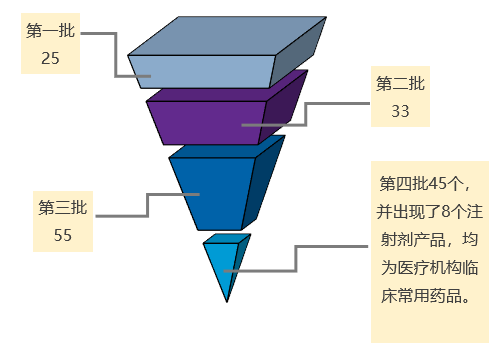
前三批集采纳入的注射剂分别有3、1、3个。第四批集采8个为常用注射剂,均为医疗机构临床常用药品,分别是氨溴索注射剂、丙泊酚中/长链脂肪乳注射剂、布洛芬注射液、多索茶碱注射剂、帕瑞昔布注射剂、泮托拉唑注射剂、硼替佐米注射剂、注射用比伐芦定产品,占集采目录总品种数的18%,成为行业关注的焦点。

资料显示,我国现有化学药品注射剂共约1500个品种,药品批准文号约3.2万个。“一致性评价工作以公众用药需求为导向,医疗机构临床常用药品尤其是大品种注射剂的一致性评价是工作重点。”周思源表示。
根据医药云端工作室统计,截止到目前已有102个注射剂品种(视同)通过一致性评价。随着注射剂过评产品的增多,预计今后将有更多注射剂被纳入国家集采,化药注射剂的一致性评价正在提速。



 个人中心
个人中心
 我是园区
我是园区




