不破不立?Science子刊揭示:遭遇致命打击时,癌细胞如何“吃自己”求生
收藏
关键词:
Science揭示
资讯来源:生物探索 + 订阅账号
发布时间:
2021-07-16
细胞质膜是包围在细胞表面的一层极薄的膜,也是其生存和发展的“保护伞”。即使“豪横”如癌细胞,质膜受损也可能会带来毁灭性的影响。目前,细胞已经发展出高效快速的修复机制来重新封闭破损的细胞膜,如果能够了解癌细胞如何从损伤中恢复的机制,或许将为癌症治疗带来新的突破口。
近日,来自丹麦癌症协会研究中心、哥本哈根大学以及南丹麦大学的研究人员在Science Advances发表了一篇题为
Restructuring of the plasma membrane upon damage by LC3-associated macropinocytosis
的研究报告,指出癌细胞能够通过大型胞饮作用(macropinocytosis),“吃掉”细胞受损区域从而在危急关头存活下来。值得注意的是,研究人员还发现了一种独特的膜重组机制,这为人们抑制癌细胞的扩散、消灭肿瘤奠定了基础。

DOI:10.1126/sciadv.abg1969
在进入正题前,需要先介绍一下与细胞损伤及修复有关的细胞自噬和大型胞饮作用。自噬一种普遍存在于大部分真核细胞中的再循环系统(recycling system),能够像“垃圾处理厂”一样,将细胞内受损的结构转化为养分被回收利用。大型胞饮作用则是通过质膜皱缩包裹内吞物形成大囊泡完成的一种胞吞作用。
先前的研究表明,细胞质膜的修复机制依赖于内吞、胞吐及膜脱落机制等生物学过程,膜联蛋白能够通过一系列反应促进细胞受损处周围的质膜融合,从而暂时阻止细胞内液体的流出。然而,在质膜闭合后细胞如何重组受损质膜,恢复细胞功能,仍然是未知数。那么,这个过程是否与细胞自噬有关呢?
为了揭开细胞修复的背后机制,研究人员使用消融激光造成人乳腺癌细胞MCF7 细胞及宫颈癌细胞HeLa 细胞损伤,结果发现,细胞能够在20-30秒内重新封闭,并且令人惊讶的是,细胞受损会造成膜褶皱,在此区域形成两种与细胞自噬有关的蛋白质囊泡:一种是源于质膜受损区域、与早期内吞作用相关的Rab5阳性大囊泡,大约在质膜损伤后2-5分钟左右开始形成;另一种是出现在修复区域的表达微管相关蛋白1轻链3(LC3,与自噬相关的蛋白质)阳性小囊泡,在细胞受损8~10分钟时形成。随着时间的推移,两种囊泡最终将在细胞修复区域共定位,并且似乎融合了。
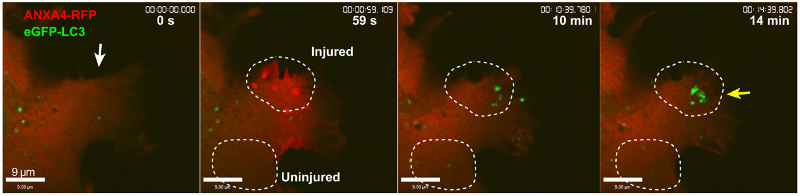
质膜受损后出现的LC3小囊泡
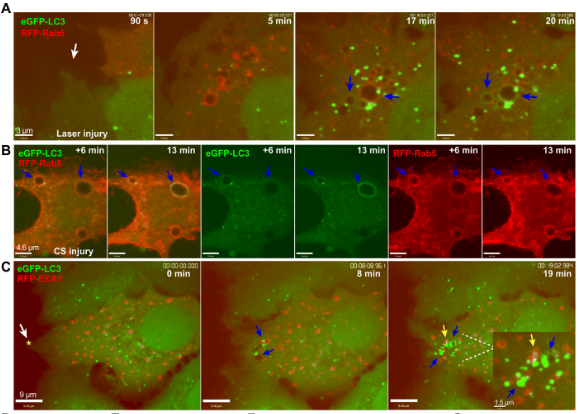
在质膜受损处出现的Rab5大囊泡
这些在质膜受损后形成的囊泡,究竟承载着怎样的“使命”?为了探究这个问题,研究人员使用共聚焦延时成像对充满了细胞外液的Rab5大囊泡的命运进行了跟踪,观察结果表明,这些囊泡后期会自发收缩,并且这种收缩似乎是受囊泡内液体的排除驱动的。另外, LC3 阳性囊泡随后似乎将与溶酶体融合,并通过溶酶体降解系统进一步内化。
上述情况说明,细胞修复似乎离不开大型胞饮作用。为了验证这一点,研究人员使用相关抑制剂处理了相关细胞,此时细胞修复进程收到显著影响, LC3 阳性囊泡的形成急剧下降,说明巨胞饮作用在细胞受损后被激活并促进了质膜重组,而LC3 囊泡则是为了响应囊泡内化而触发的。
简而言之,经过消融激光损伤的细胞,能够将完整的细胞膜拉入受损区域,从而在几分钟内封闭细胞。随后,细胞将通过大型胞饮作用将受损区域以囊泡的形式运送到细胞内部进行“回收利用”,如果该过程被阻止,细胞将无法再修复损伤并死亡。
值得注意的是,在这项新研究中,研究人员还发现的质膜修复过程是通过触发先前未知非典型自噬过程实现的。通常,细胞自噬是由ULK1/ATG13/ WIPI2通路启动,但是在这项研究中的细胞却“不走寻常路”,并且该过程与高度依赖rubicon蛋白的非典型自噬——LC3相关自噬(LAP)类似,研究人员将这种新发现的非典型自噬过程称为与LC3相关的大型胞饮作用(LAM)。
不仅仅是帮助受损细胞恢复,2020年 Nature Communications 上的一篇文章指出,大型胞饮作用还是肿瘤耐药的重要原因,而阻断该过程能够恢复癌细胞对药物的敏感性。

https://doi.org/10.1038/s41467-020-14928-3
总之,这项研究表明,细胞在受损后会触发巨胞饮作用来“疗伤”。该报告的通讯作者、丹麦癌症协会研究中心的Stine Lauritzen Sønder说:“我们认为,癌细胞在质膜受损后通过巨胞饮作用恢复的过程或许并不是终点,这可能只是应急措施,之后癌细胞或许进行更彻底的修复,而这或许能够帮助我们发现癌细胞的另一个弱点,我们将继续探索。”
参考资料:
[1]https://advances.sciencemag.org/content/7/27/eabg1969
[2]https://medicalxpress.com/news/2021-07-cancer-cells-survive.html
[3]https://www.nature.com/articles/s41467-020-14928-3#article-info
本文系生物探索原创,欢迎个人转发分享。其他任何媒体、网站如需转载,须在正文前注明来源生物探索。
免疫疗法 | 生物仿制药 | 疫苗 | 耐药性 | 药物靶点 | 健康生活 | 药企新闻 | 药物盘点 | 制药技术 | 药物副作用
白血病
| 肺癌
| 胃癌
| 结直肠癌
| 肝癌
| 乳腺癌
| 胰腺癌
| 心血管疾病
| 神经退行性疾病
| 肠道微生物
体外诊断
| 医疗器械
| 生物纳米
| 3D打印
| 基因检测
| 单细胞测序
| 基因编辑
| 辅助生殖
| 人工智能
| 精准医学
抗癌药
| 4+7带量采购
| 耗材
| 备案制
| 注册人制度
| 健康中国
| 新版基药目录
| AI医疗器械
| 远程医疗
| 同股不同权
IPO
| 融资
| 合作
| 基金
| 港交所
| 科创板
| 创业板
| 研发投入
| 收购
| 市场&消费








 个人中心
个人中心
 我是园区
我是园区




