速递 | 乐普生物抗PD-1抗体获批上市,治疗“泛癌种”
收藏
关键词:
治疗上市获批PD-1抗体癌乐普生物
资讯来源:药明康德 + 订阅账号
发布时间:
2022-07-25
▎药明康德内容团队报道
日前,中国国家药品监督管理局(NMPA)官网最新公示,乐普生物抗PD-1抗体普特利单抗注射液的上市申请已获得批准
。公开资料显示
,此次该产品获批的适应症为:
适用于既往接受一线及以上系统治疗失败的微卫星高度不稳定(MSI-H)/错配修复功能缺陷(dMMR)实体瘤患者的治疗
。

据乐普生物早前公开资料介绍,普特利单抗(pucotenlimab)是通过使用人IgG4亚型针对人PD-1的人源化单抗。它可以拮抗PD-1信号,通过阻断PD-1与其配体PD-L1及PD-L2的结合来恢复免疫细胞杀死癌细胞的能力。同时,
普特利单抗采用抗体工程技术,于Fc区引入突变,提高FcRn的结合亲和力,从而大幅延长其半衰期,提高患者的临床疗效及药物依从性。
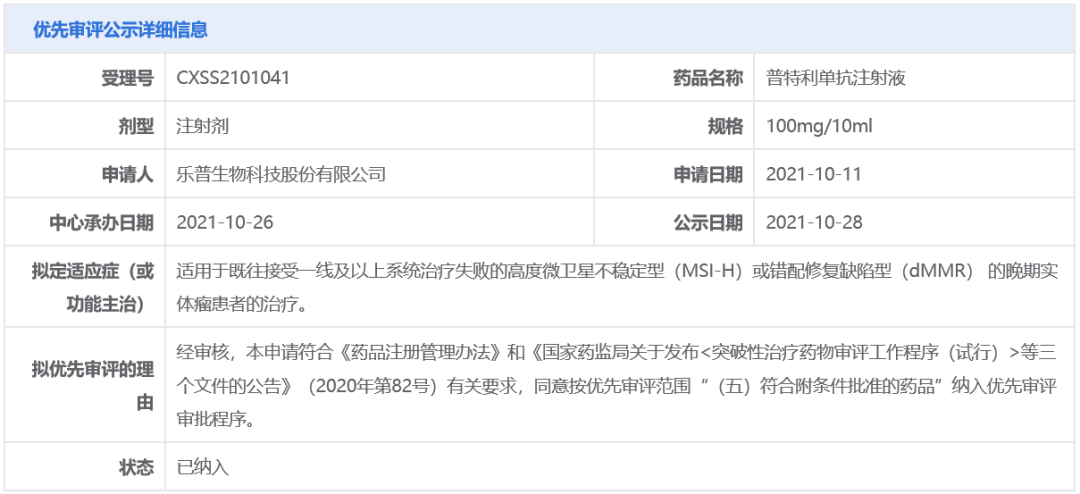
根据公开资料,乐普生物分别于2021年6月和2021年10月向NMPA提交了普特利单抗的2项适应症上市申请,分别用于治疗黑色素瘤和MSI-H/dMMR实体瘤。其中
,MSI-H/dMMR实体瘤的上市
申请
还曾被中国国家药监局药品审评中心(CDE)纳入优先审评,具体适应症为:
适用于既往接受一线及以上系统治疗失败的
MSI-H或dMMR的晚期实体瘤患者的治疗。
此次,普特利单抗获批的适应症即为MSI-H/dMMR实体瘤。MSI-H与dMMR是常见的遗传异常,含有这类变异的肿瘤会影响细胞内的DNA修复机制,可出现在乳腺、前列腺、结直肠、胃等多个部位。
在2021年美国临床肿瘤学会(ASCO)会议上,乐普生物汇报了普特利单抗用于MSI-H/dMMR实体瘤的多中心2期临床研究结果。数据显示,在共纳入100名均为二线及以上的患者中,86例达到初步反应评价。研究主要终点客观缓解率(ORR)达到47.67%,疾病控制率(DCR)为75.58%,6个月和12个月无进展生存期(PFS)率分别为62.66% 和52.70%。结果表明,普特利单抗在二线及以上MSI-H/dMMR晚期实体瘤患者中显示出有希望的疗效和可控的安全性。
除了
MSI-H/dMMR实体瘤,
乐普生物还在其它适应症上探索普特利单抗的治疗效果,例如黑色素瘤、
胃癌或胃食管结合部癌二线治疗、非小细胞肺癌(NSCLC)、
三阴性乳腺癌(TNBC)、非肌层浸润性膀胱癌(NMIBC)、肝细胞癌(HCC)等。此外,该公司还正在开展普特利单抗与溶瘤病毒产品、抗PD-L1抗体等联合疗法的临床试验。
希望乐普生物普特利单抗此次获批上市,能够为更多癌症患者提供新的治疗选择。
参考资料:
[1]2022年07月22日药品批准证明文件待领取信息发布 .Retrieved July 22,2022, from https://www.nmpa.gov.cn/zwfw/sdxx/sdxxyp/yppjfb/20220722090109108.html
[2]
乐普生物招股书. Retrieved Apr 28, 2021, from https://www1.hkexnews.hk/app/sehk/2021/103373/documents/sehk21042802764_c.pdf
[3] Efficacy of HX008 in high microsatellite instability/mismatch repair–defificient (MSI-H/dMMR) solid tumors: Results from a multicenter phase II open-label study. From https://ascopubs.org/doi/abs/10.1200/JCO.2021.39.15_suppl.2572
[4]乐普生物发布2021年全年业绩报告|资本市场助力,临床管线多点开花 . Retrieved Mar 29,2022, from https://mp.weixin.qq.com/s/V_3DiYK0FrqsVEC40dh0vg
本文来自药明康德内容团队,欢迎个人转发至朋友圈,谢绝媒体或机构未经授权以任何形式转载至其他平台。转载授权请在「医药观澜」微信公众号留言联系我们。其他合作需求,请联系wuxi_media@wuxiapptec.com。
免责声明:药明康德内容团队专注介绍全球生物医药健康研究进展。本文仅作信息交流之目的,文中观点不代表药明康德立场,亦不代表药明康德支持或反对文中观点。本文也不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。








 个人中心
个人中心
 我是园区
我是园区




