
今年8月底,知名药物化学科学家吴永谦博士创立的小分子新药研发公司药捷安康,正式公告向港交所提交A1申请,港股18A公司阵营由此再添一家新贵。这家坐落于南京的公司,虽不似某些明星公司一般早早就名声在外,然而在业内看来,其在管线布局、研发速度及临床进展等诸多方面,着实值得称道。
特别是其核心产品TT-00420,以其独特机制解决了尚未有治疗手段的临床问题,还入选了CSCO2021大会的“第二届肿瘤诊疗黑科技大会“TOP20项目,并在决赛答辩中深受众多投资者及专家青睐,摘得第三名的好成绩。
吴永谦:成功融入本土的海归大咖

药捷安康的创始人吴永谦博士拥有超过25年生物医药行业经验,是中国创新药圈内成名已久的海归科学家。尤其值得称道的是,吴博士无论是早年在海外跨国药企或生物技术公司,亦或是归国后成功领导国内企业的研发及管理,均有着显赫的研发业绩,这样的成功转型实属不易。
吴博士90年代进入美国创新药研发领域,曾就职于Boehringer-Ingelheim,负责免疫学及心血管药物研发。归国后,吴永谦博士曾任四环医药首席科学家兼轩竹医药总经理,管理由8名海归和超过200名研发人员组成的研发团队,为企业建立了完善的新药研发体系。
轩竹期间,吴永谦博士共领导申报了11个1.1类新药,其中10个获得临床批件,7个进入临床(包括在美国的临床实验)。申请超过50余件专利。6个项目获得国家11.5、12.5新药创制重大专项支持,共获得超过4000万元资助。完成与NeuroVive (EU,in-license),2-BBB (EU,partnership),RaQualia等公司的国际合作。
作为创新药企业的创始人,除了卓越的科学研究能力外,还应当有足够的能力引领团队和企业应对发展过程中的诸多挑战,尤其是面对突发状况时的风险管理能力。
较早开始接触药捷安康的投资人或许还有印象,公司早期主打的一个项目是一款IDO抑制剂,此前应该是国内进展最快的IDO靶点项目。就在其IDO抑制剂即将申报临床时刻,突遇美国Incyte公告IDO项目III期研发失利。此时又恰逢药捷安康某轮融资的关键节点,可以想象这一黑天鹅事件在给公司带来的重大利空。即便如此,吴博士依然带领药捷安康团队扛住了这个至暗时刻,并先后完成了公司的融资和管线调整,逐渐从海外IDO靶点失利的阴影中走出。这般摔倒再爬起的经历,证明了药捷安康成长的韧性,也成为公司发展历程中弥足珍贵的财富。
差异化特色管线和亮眼国际化合作

药捷安康专注于研发肿瘤、炎症及心血管疾病小分子创新疗法,其管线布局呈现出鲜明特色和差异化优势,且研发团队拥有极强的执行效率,从2016年吴永谦博士正式加入至今,五年内已有5个项目进入美国/中国临床阶段,其中4个均为自主源头创新产品。中美两地同步开展的多项临床研究包括针对胆管癌(CCA)、三阴乳腺癌(TNBC)、心衰等多项重大临床需求未被满足的疾病。其核心产品TT-00420已经获得优异的临床数据,未来有望凭借其在FDA获得的孤儿药及Fast Track认证迅速上市,此外在多项实体瘤的延展性也具有后劲。同时,其他管线在全球平行推进,也十分令人期待。
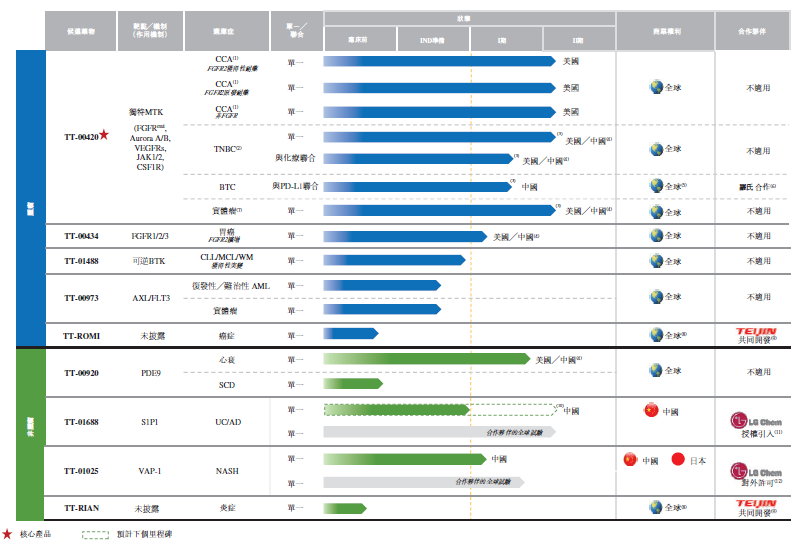
药捷安康的另一大特色是广泛而多元的国际化合作。近年来,国内Biotech公司的各类型全球合作交易数量正在快速增长,涌现出百济&Amgen和加科思&Abbvie这样的顶级交易。在这其中,药捷安康创新药TT-01025的 license-out案例也打破了当时的中国小分子对外许可交易金额记录。药捷安康开展的多层次、多维度的全球研发合作,不仅数量和质量在国内较为领先,而且特色鲜明。迄今为止,药捷安康已经与多家全球领先的制药公司建立深度合作关系,合作形式包括License in/License out、合作研发、临床合作:
对外授权:2020年8月,药捷安康将TT-01025除大中华区及日本以外的全球权利授权LG Chem,其负责大中华及日本以外地区的全球开发。
临床合作:2021年,药捷安康与Roche签订合作协议,探索TT-00420和阿替利珠单抗联合治疗中国胆道系统肿瘤患者的潜在价值。此外,公司还与FoundationMedicine合作探索TT-00420对于FGFR变异患者的Biomarker。
联合研发:2020年,药捷安康与Teijin签订两份战略合作协议,以在肿瘤及炎症性疾病的目标领域联合研发创新药物。
授权引进及专利收购:2021年4月,药捷安康自LG Chem授权引进新型S1P1受体调节剂TT-01688,以于大中华区开发及商业化。
这些全球合作一方面加强了药捷安康自身的全球管线及加速临床开发的能力,提高了国际知名度,同时也为中国Biotech公司的全球合作探索了新路径。
真正解决FGFR耐药和高异质性肿瘤
未满足临床需求

药捷安康的核心产品TT-00420是一款自主研发的独特激酶抑制剂,目前在中美两地已有多项临床正在或者即将开展。
TT-00420的第一个特点是靶向FGFR。目前FGFR赛道已经看似拥挤,而药捷安康的产品却是另辟蹊径的全新一代。TT-00420凭借其独特结构及活性,有着与上一代FGFR抑制剂显著不同的特色,并由此在临床中展出针对耐药突变、原发突变、复发/难治肿瘤的差异化优势。
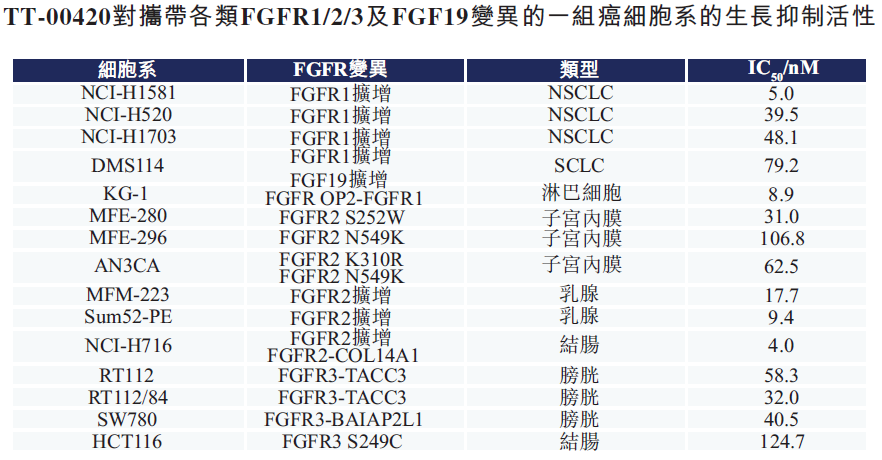
TT-00420基于其与FGFR2独特的结合方式,使得该化合物能够克服胆管癌患者的获得性耐药和原发耐药。进一步研究表明,TT-00420对于FGFR1及FGFR3突变也有相似疗效,由此为相关突变的多种实体瘤,包括膀胱癌、子宫内膜癌、非小细胞肺癌和结肠癌都带来治疗希望。此外,科学研究发现异质性肿瘤之所以难治,很有可能是因为它的发生和发展与多个靶点具有相关性。TT-00420作为多激酶抑制剂,选择性地抑制多靶点通路,从而起到协同作用,使其在许多高度异质性的肿瘤(如三阴乳腺癌(TNBC)和没有明确标志物的胆管癌)方面展现出独特的治疗潜力。

FGFR的获得性耐药突变与我们熟悉的EGFR耐药突变只有一个T790M突变位点不同,目前研究发现FGFR2的耐药突变位点共有11个。因此,要想解决FGFR2的耐药突变问题,需要同时能够打到这11个突变位点,并且每个位点活性都要高,才能达到治疗耐药突变的效果。否则如果对任何一个突变位点活性不够,都会导致抑制耐药突变失败。这也是为什么迄今为止,国内外的FGFR的开发大都聚焦于一代FGFR抑制剂,真正专注于解决FGFR耐药问题的公司凤毛麟角,仅在美国有少数biotech公司在做尝试,但是在进度和疗效上都不及药捷安康。
根据药捷安康招股书披露,临床前对化合物结合的共结晶结果表明, TT-00420与FGFR2激酶结构域的结合呈现出完全不同的空间构象,使其远离高频获得性突变残基,并且与铰链区氨基酸骨架残基形成三个氢键,产生高亲和力活性和持久结合。这样独特的结合机制使其能够抑制迄今为止临床发现的全部11种FGFR2获得性突变,包括V564F、N549K、C491S等,并且都具有有效的高抑制活性。目前全球药品研发市场上尚未有竞品达到类似效果。
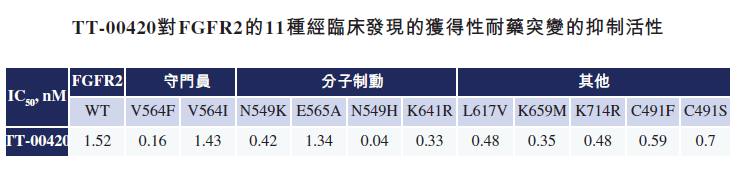
TT-00420 针对FGFR耐药突变的优势在已经开展的临床试验中也获得了验证。在I期临床研究中,TT-00420对5名先前使用过培米替尼、infigratinib、ARQ-087及furtibatinib等FGFR抑制剂进而发生疾病进展耐药的胆管癌患者表现出极具前景的疗效截至2021年8月17日,在该类患者观察到100%的疾病控制率。一名患者实现部分缓解(PR),四名患者实现疾病稳定(SD)。除基因融合或重排外,另一组胆管癌患者在发生FGFR2跨膜区、胞外区及激酶结构域发生突变而导致原发耐药。该等患者在其临床试验中对培米替尼并无反应。于I期试验中,公司招募了一名出现原发耐药的胆管癌(CCA)患者。该患者的肿瘤缩小40%以上,无进展生存期为八个月。这一令人鼓舞的临床数据证明了TT-00420对出现原发耐药的胆管癌患者进行进一步临床研究的可能性。
TT-00420对FGFR1/3靶点有着与FGFR2类似的结合模式,因此对于克服FGFR1/3突变显示出巨大潜力。在公司的临床前研究中,除高效抑制野生型激酶外,TT-00420对于FGFR1/3的守门员突变也表现出强效的抑制作用(IC50值小于或等于5nM),这些数据表明TT-00420能够可适用于多种携带FGFR1/2/3突变的实体瘤,包括前列腺癌、膀胱癌、子宫内膜癌、非小细胞肺癌(NSCLC)及结肠癌。
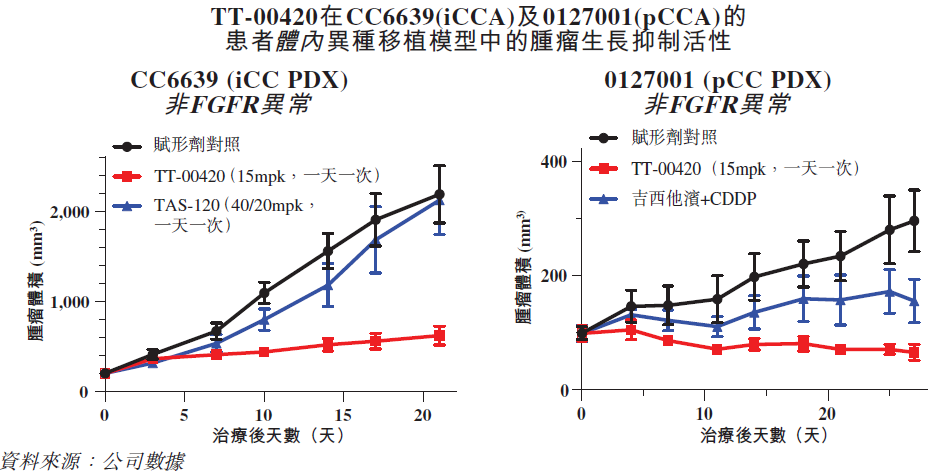
除强效抑制FGFR1/2/3之外,TT-00420作为激酶谱选择性激酶抑制剂,对Aurora A/B、CSF1R、JAK1/2及VEGFR等靶点也有抑制作用。这样独特的靶点组合,使得该化合物在无FGFR突变的胆管癌中具备抗肿瘤治疗潜力,这也在公司的两项临床前针对无FGFR突变的肝内胆管癌及肝门部胆管癌患者来源异种移植瘤(PDX)模型中得以验证(化疗和泛FGFR抑制剂futibatinib仅有极小肿瘤抑制作用)。
与此同时,针对诸如TNBC这类高度异质性肿瘤,TT-00420也显示出较强的治疗潜力。公司的临床前研究中,包括针对8株TNBC细胞系以及12例PDX模型(代表7种TNBC分子亚型中的6种),均显示出肿瘤生长抑制效果。在I期临床中,入组的7例TNBC患者也获得了和上述I期CCA患者类似的疗效。
TT-00420 I期数据:针对胆管癌和
三阴乳腺癌治疗的良好前景

TT-00420已经开展的临床研究汇总如下,其中TT420X2101和TT420HV1102两项I期研究已经完成。
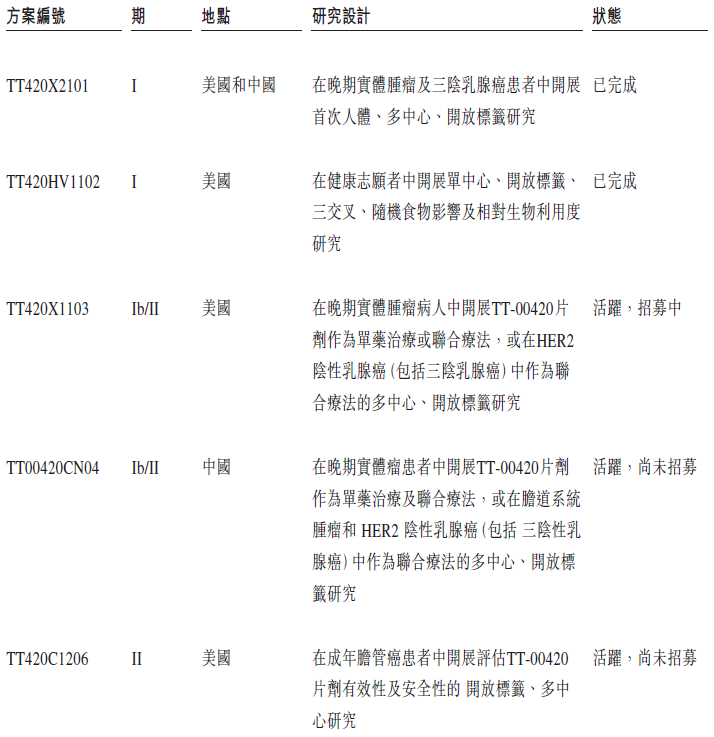
TT420X2101是一项在中美同步开展的I期研究,主要招募晚期TNBC和其他实体瘤患者,对TT-00420进行单药口服剂量探索,评估安全性、耐受性、PK以及初步疗效等方面。该项研究共入组40例晚期实体瘤患者,最高剂量爬坡到15mg。
该项研究已于2021年6月完成。TT-00420总体耐受性良好,不良事件多为1级和2级,没有4级,极少有严重不良事件出现。
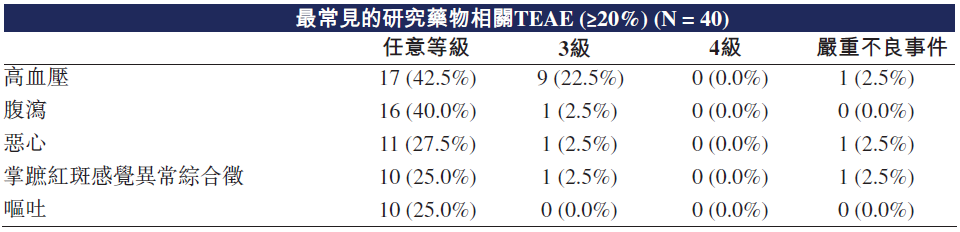
疗效方面,至数据截止日期,对35名至少进行过一次治疗后扫描的可评估患者的初步肿瘤反应进行评估,结果包括5例PR(2例胆管癌,2例乳腺癌,1例前列腺癌),20例SD。
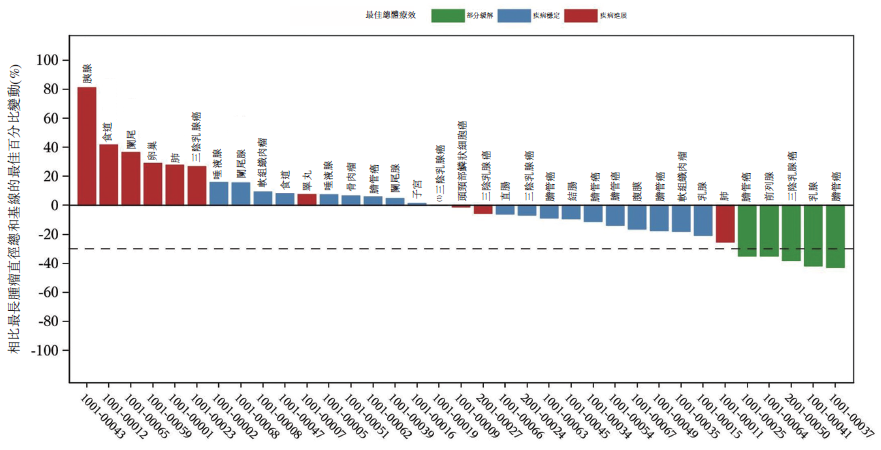
7例胆管癌患者参与评估,其中包括5例FGFR2融合或重排,且对先前FGFR抑制剂治疗产生获得性耐药。结果显示,7例患者中包括2例PR,5例SD,整体疾病控制率(DCR)100%。此外,可评估的7例乳腺癌患者中,包括1例TNBC和1例HER2阴性患者达到PR,另有2例TNBC和1例HER2阴性患者达到SD。这些初步疗效数据均表明,TT-00420对胆管癌、TNBC和其他适应症患者均有潜在临床益处。
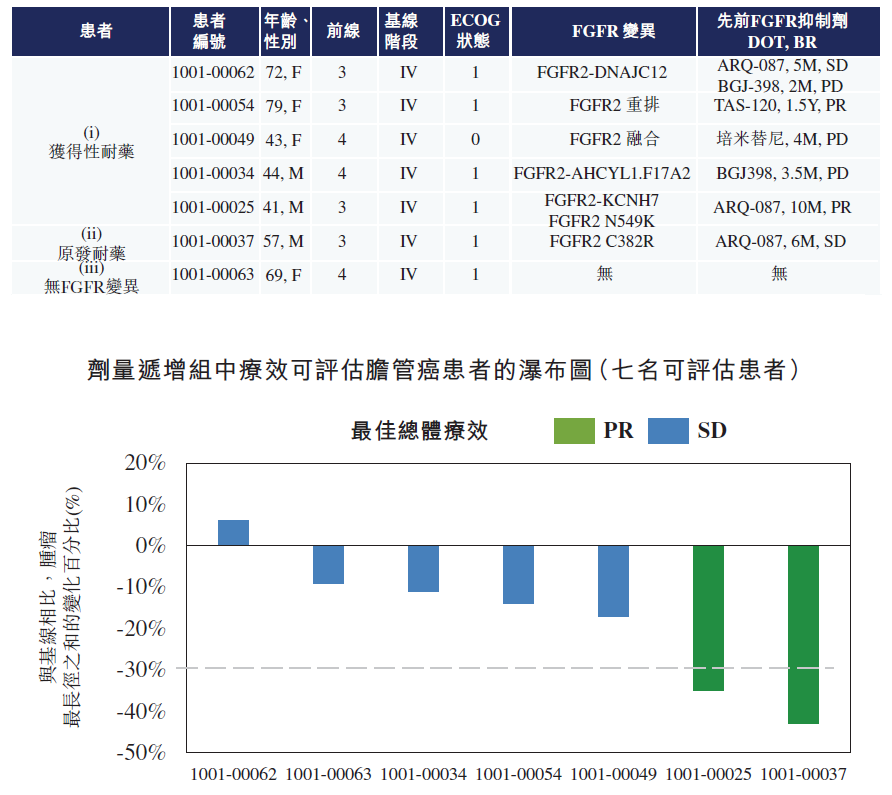
除基因融合或重排之外,对于因发生在FGFR2跨膜区、胞外区及激酶结构域突变,并对培米替尼无反应的原发耐药类胆管癌患者,也在TT-00420的I期研究中展现出不错的前景。1名这类患者的肿瘤缩小了40%以上,出现了8个月的无进展生存期(PFS),这些都为TT-00420证明了原发耐药的胆管癌患者进行进一步临床研究提供了可能性
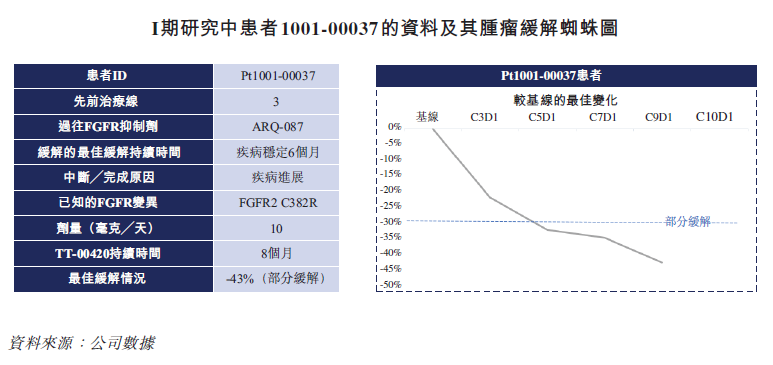
针对FGFR1/3方面,I期共入组了2名FGFR1/3突变的患者。经治疗后,1名FGFR1扩增的结直肠癌患者达到SD,另一名FGFR2扩增的前列腺癌患者达到PR。这些临床信号都为后续TT-00420在FGFR1/2/3突变实体瘤的进一步研究提供了依据。
此外,TT-00420多靶点的特性也使得其展现出与化疗、抗体等药物联用中担当基石药物的潜力,临床前的多项研究也证明了这一点。
另一项TTH420V1102是一项旨在评估食物对TT-00420片剂药代动力学的影响,并确定TT-00420片剂与TT-00420胶囊在成人健康志愿者体内的相对生物利用度。结果显示,片剂和胶囊的药物暴露量相当,未观察到食物对TT-00420片剂的影响。片剂或胶囊在健康者愿者体内耐受性和安全性良好。
TT-00420还有多项单药或联用的Ib/II期临床试验在中美两地开展。整体策略方面,公司计划将TT-00420作为单药治疗通过孤儿药快速审批迅速推向市场,主打于没有标准治疗方案的二线或者晚期胆管癌患者,并同时开展临床扩展到其他适应症,诸如TNBC等,并进一步探索与化疗或者PD-L1抗体治疗不同瘤种的联合疗法。同时,随着市场的成熟,进一步向一线治疗推进。
TT-00920:靶向治疗慢性心衰的口服PDE9抑制剂

药捷安康的另一项关键产品,TT-00920是一款高选择性的口服PDE9抑制剂,治疗慢性心衰,具有全新生物学作用机制。
PDE9在心肌细胞中表达,负向调节心脏内源保护性利钠肽(NP)-偶联cGMP信号通路。其蛋白水平在心衰病人中显著升高,且与心力衰竭患者的心室功能有关,具有强有力的疾病相关性。TT-00920通过抑制PDE9来激活的NP/cGMP通路,其独特作用机制可能与现有的治疗方法协同,形成一种创新的心衰治疗方案。
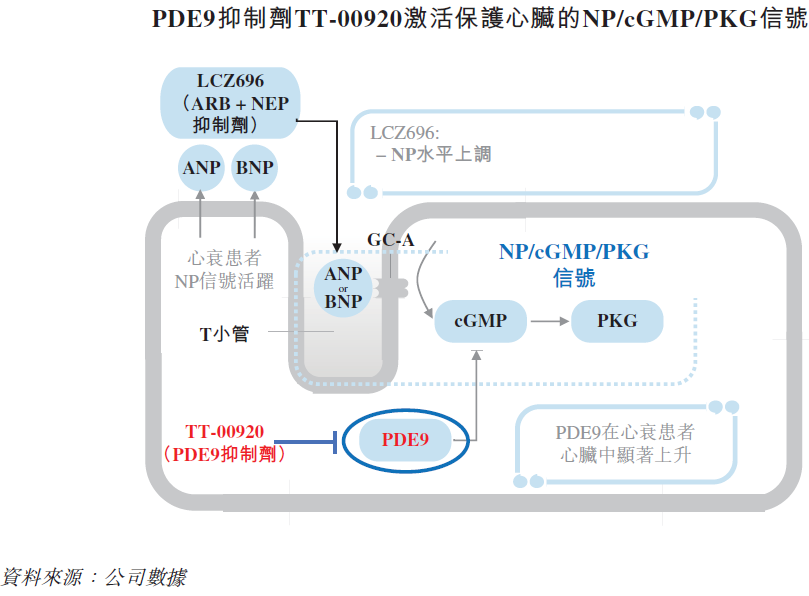
临床前研究表明,TT-00920恢复了心脏NP/cGMP信号,显著增强心脏功能并逆转了心衰的心室重构。TT-00920对PDE9具有高活性和高选择性的特点,其靶点的安全性已在其他针对CNS疾病的临床在研PDE9抑制剂上的得到验证。与靶向中枢神经系统(CNS)的PDE9抑制剂如BI-409306和PF-044447943相比,TT-00920表现出低CNS暴露及高心脏分布,有利于心衰治疗,同时避免CNS不良反应发生。
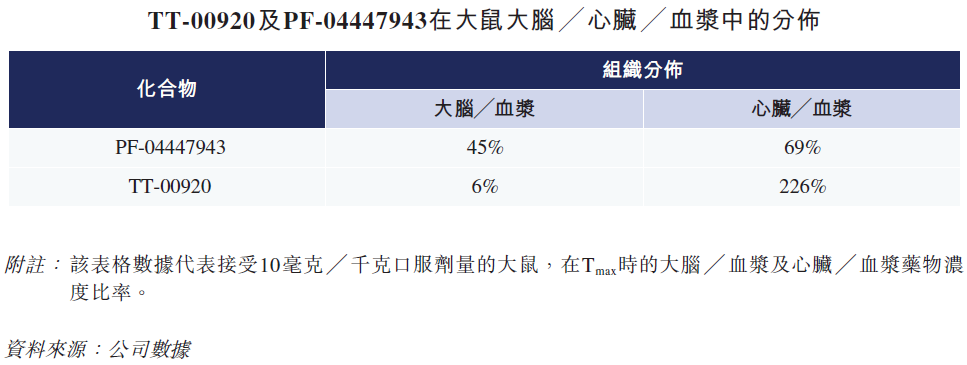
药捷安康目前已在美国健康志愿者体内中启动TT-00920的I期研究,目前已完成单剂量递增研究,并继续进行多剂量递增研究,预期于2021年完成受试者入组。中国的I期研究也已经启动。公司计划于2022年下半年启动全球II期临床试验。
TT-01688: 针对自体免疫疾病的高选择性
口服S1P1受体调节剂

TT-01688是一款授权引进的针对多种自体免疫疾病的高选择性口服S1P1受体调节剂,目前处于临床II期阶段。经LG Chem授权,药捷安康获得了该产品大中华区的独家开发及商业化权利。
S1P1受体于淋巴细胞表达,在调节淋巴细胞自淋巴组织的外流过程发挥关键作用,是一个很有前景的自体免疫病靶点, 其靶点安全性良好。S1P1受体调节剂通过结合并诱导S1P1受体内吞和降解,减少循环淋巴细胞。其溃疡性结肠炎(UC)的治疗前景已在临床上通过奥扎莫德获得验证。越来越多的临床证据亦可支持S1P1受体调节剂用于多种其他免疫适应症,包括特应性皮炎(AD)及克罗恩病(CD)。
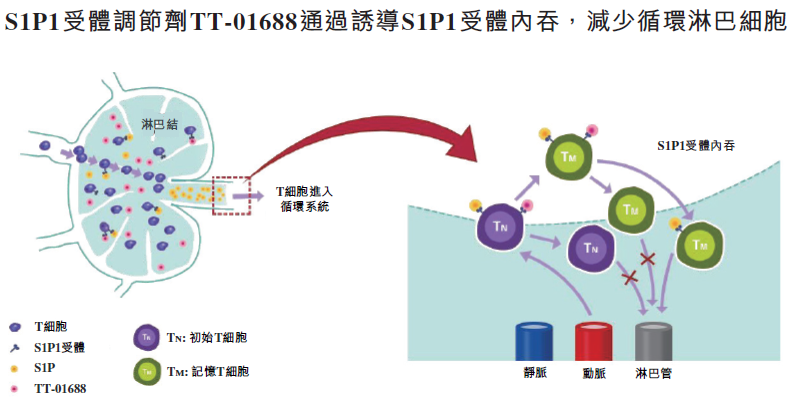
TT-01688是目前位于临床研究前沿的高选择性S1P1受体调节剂,对S1P2、S1P3及S1P4具有高选择性,药物相互作用和心血管副作用潜在风险低。临床前及I期研究已经证明TT-01688对S1P1靶点的高度选择性及出色的机制相关PK/PD特征。
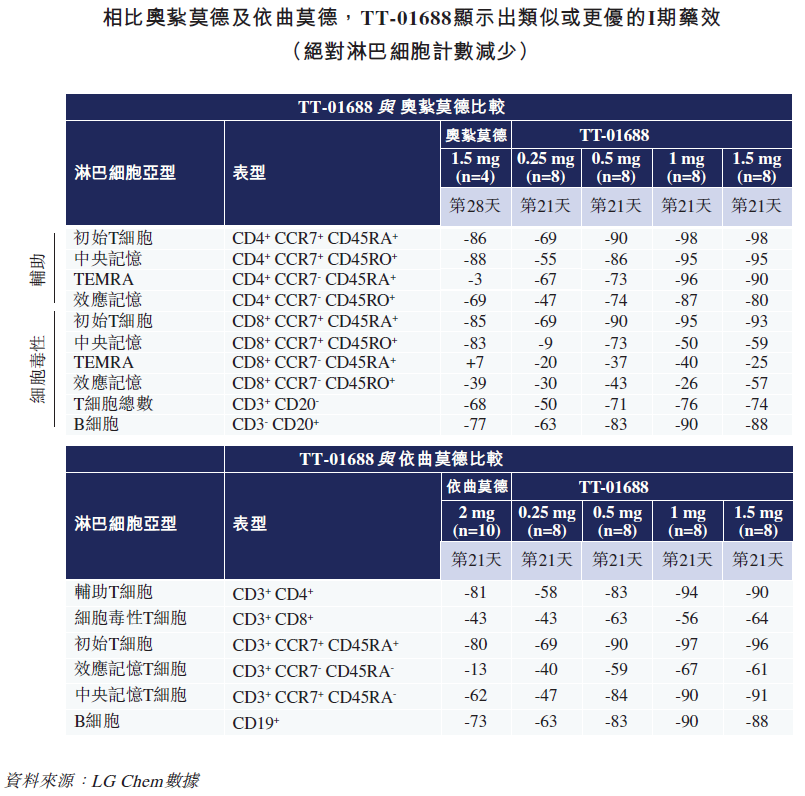
LG Chem已在韩国完成TT-01688的I期研究,并在美国获批II期临床。药捷安康于2021年4月引进TT-01688,获得大中华区的开发和商业化授权,计划在2022年上半年在中国启动用于治疗UC的TT-01688的II期临床试验。
除以上这些品种之外,药捷安康管线上还拥有具备业内领先的新一代高选择性高活性的非共价可逆BTK抑制剂TT-01488,新型AXL/FLT3双重抑制剂TT-00973等多个计划在今明两年向中美提交IND的后续品种。公司未来登陆资本市场后,预计将会持续有诸多全新进展和利好释放,整体前景值得期待。

温馨提示
医药魔方记录行业发展,揭示产业趋势,持续输出具有行业理解和深刻洞见的内容,包括药品市场格局变化、医药行业趋势演变、政策解读、代表性公司业务分析、医药行业标杆人物专访、重磅事件解读等,帮助用户理解医药行业生态和演变,辅助行业用户决策。
星标⭐医药魔方,这样就不会错过我们的推送啦~

操作步骤见上图:1)点击标题下方“医药魔方”,2)至右上角“…”,3)设为星标



 个人中心
个人中心
 我是园区
我是园区




