「 本文共:15条资讯,阅读时长约:3分钟 」




1.信立泰引进HIF-PHI抑制剂获批上市。信立泰从Japan Tobacco公司引进的口服小分子创新制剂恩那度司他(恩那罗,enarodustat)获国家药监局(NMPA)批准上市,用于非透析的成人慢性肾脏病(CKD)患者的贫血治疗。enarodustat是一款口服活性低氧诱导因子脯氨酰羟化酶抑制剂(HIF-PHI),通过增加内源性促红细胞生成素生成、改善铁的吸收、下调铁调素水平来促进红细胞的合成,进而治疗贫血。
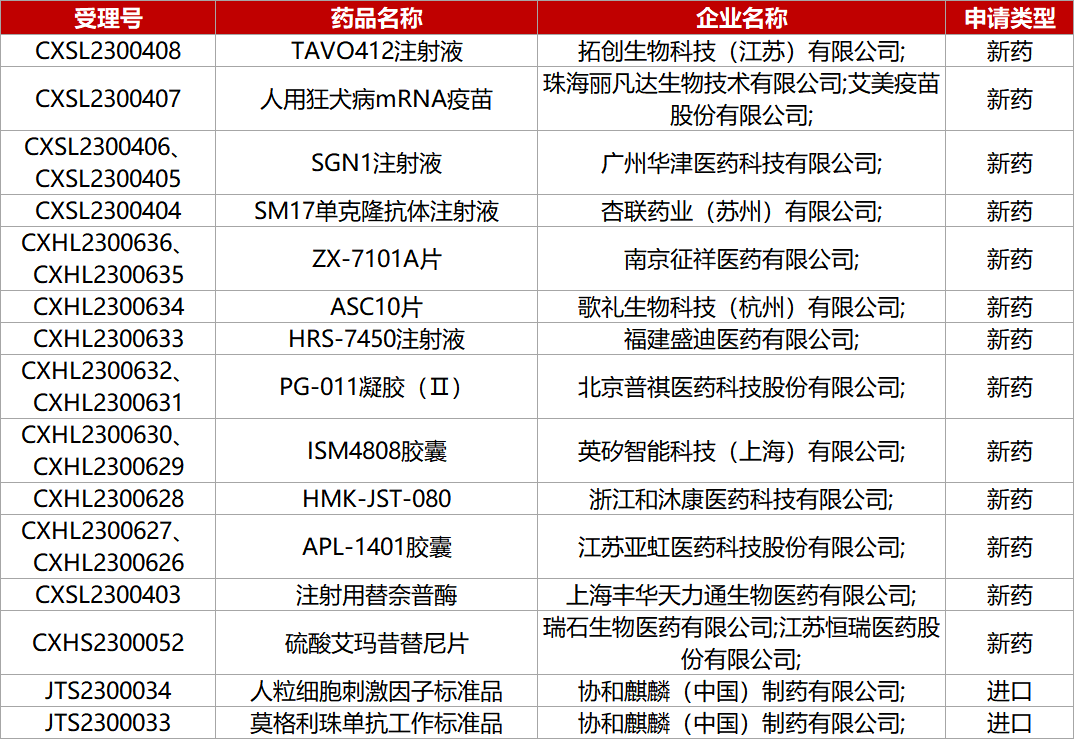
2.恒瑞JAK1抑制剂报皮炎NDA。恒瑞医药1类化药硫酸艾玛昔替尼片的上市申请获CDE受理。艾玛昔替尼(SHR0302)是一款新一代JAK1抑制剂,已在治疗特应性皮炎的国际III期临床RSJ10333(QUARTZ 3)达到共同主要终点及所有关键次要终点。与安慰剂相比,接受SHR0302(8mg、4mg)治疗16周时达到IGA 0/1应答的患者比例更高(42.0%和36.3%,vs9.0%),以及达到EASI 75应答的患者比例也显著更高(66.1%和54.0%,vs21.6%)。
3.泽璟LAG-3/TIGIT双抗美国获批临床。泽璟制药宣布LAG-3/TIGIT双抗注射用ZGGS15获FDA批准,即将开展用于治疗晚期实体瘤的临床研究。在临床前动物模型中,ZGGS15单药具有较好的抗肿瘤增殖作用,且该产品与PD-1抗体联合具有比抗LAG-3单抗或抗TIGIT单抗与PD-1抗体联合更好的协同增强抗肿瘤增殖的作用,并具有良好的安全性。今年4月,该新药已在国内获批临床试验默示许可。
4.BMS蛋白降解疗法中国获批临床。百时美施贵宝旗下新基1类化药iberdomide胶囊(CC-220)获国家药监局临床试验默示许可,拟开发用于新诊断的多发性骨髓瘤(MM)患者在接受自体干细胞移植(ASCT)后的维持治疗。iberdomide是一款CELMoD分子胶类化合物,通过与E3泛素连接酶Cereblon结合,改变其底物特异性,促进对IKZF1/3蛋白的降解,不但提高肿瘤“自杀”的活性,而且刺激效应免疫细胞的增殖。
5.艾美狂犬病mRNA疫苗报IND。艾美疫苗旗下丽凡达生物1.2类生物制品“人用狂犬病mRNA疫苗”临床试验申请获CDE受理。这是国内首款申报临床的狂犬病mRNA疫苗。与传统的人用狂犬病疫苗相比,mRNA狂犬病疫苗具有更高的免疫原性、获得免疫力所需的剂量更少以及更易于生产等特点,通过降低将灭活病毒或外来细胞注入人体的有关风险,有望提供更高的安全性。


1.默沙东来特莫韦新适应症获批。默沙东抗病毒药物Prevymis(letermovir,来特莫韦)获FDA批准新适应症,用于预防处于高风险的成人肾脏移植受者(供体巨细胞病毒[CMV]阳性/受者CMV阴性[D+/R-])的CMV疾病。letermovir是一种新型非核苷CMV抑制剂(3,4-二氢喹唑啉),通过特异性靶向病毒终止酶复合物来抑制病毒复制。此前,该新药已获得FDA批准,用于血液干细胞移植(HSCT)患者防止CMV感染和相关疾病。
2.环孢菌素A制剂获批干眼症NDA。Novaliq公司0.1%环孢菌素A制剂CyclASol(VEVYE)获FDA批准上市,用于治疗干眼病。在关键III期临床(ESSENCE-2)中,与对照组相比,CyclASol组第29天时患者的全角膜荧光素染色评分较基线显著改善(p=0.0278);在4周内产生应答(角膜染色改善≥3级)的患者比例更高(71.6%,p=0.0002)。恒瑞拥有CyclASol的中国权益。
3.卫材/渤健Aβ抗体获FDA推荐上市。FDA外周和中枢神经系统药物咨询委员会推荐批准卫材与渤健开发的阿尔茨海默病(AD)抗体疗法Leqembi(lecanemab)由加速批准转为完全批准,FDUFA日期定为2023年7月6日。Leqembi能与可溶性Aβ聚合体结合,并且促进它们的清除。一项III期CLARITY AD研究长期疗效数据显示,与标准护理相比,lecanemab治疗能够延缓(大约延缓两到三年)AD患者进展到更严重的疾病阶段。
4.默沙东K药报胆道癌联合用药sBLA。FDA受理默沙东PD-1单抗Keytruda的补充生物制品许可申请(sBLA),与化疗(吉西他滨和顺铂)联合一线治疗晚期或不可切除胆道癌(BTC),PDUFA日期为明年2月7日。在III期KEYNOTE-966研究中,Keytruda联合治疗较单独化疗显著改善患者总生存期(12.7vs10.9个月;P=0.0034)。据了解,晚期胆道癌治疗选择有限且预后较差,5年生存率约为5%~15%。
5.阿斯利康FIC口服PNH新药III期临床成功。阿斯利康旗下Alexion公司潜在“first-in-class”口服补体因子D抑制剂danicopan联合标准治疗药物C5抑制剂Ultomiris或Soliris治疗阵发性睡眠性血红蛋白尿(PNH)的III期ALPHA达到主要和关键次要终点。与安慰剂相比,danicopan联合治疗显著改善患者血红蛋白水平较基线的变化(2.94[0.211]g/dLvs 0.50[0.313]g/dL)。danicopan总体耐受性良好,未发现新的安全性问题。
6.首个CRISPR基因编辑疗法获优先审评。FDA受理Vertex公司与CRISPR公司开发的一次性、自体细胞疗法exagamglogene autotemcel(exa-cel)治疗严重镰刀型细胞贫血病(SCD)和输血依赖性β地中海贫血(TDT)的生物制品许可申请(BLA),并同时授予该产品治疗SCD的优先审评资格。如果获批,exa-cel将成为首款CRISPR基因编辑疗法。在两项临床中,随访为1.2~37.2个月时,有42例(n=44)TDT患者不再依赖输血,患者平均总血红蛋白水平超过11 g/dL;所有31例接受治疗的SCD患者在随访2.0~32.3个月期间,均未出现血管闭塞性危象。


1.江苏第三家帕金森病高级诊疗中心授牌。5月28日,“中国帕金森病专科中心暨帕金森病一站式诊疗中心”在南京授牌,江苏省人民医院(南京医科大学第一附属医院)被授予中国帕金森病专科中心暨帕金森病一站式高级诊疗中心。这是江苏省第三家帕金森病高级诊疗中心,将依据“一个中心、一站服务、一个标准、全程管理”的指导原则,为帕金森病患者提供专科化、精准化、全程化的诊疗服务。
2.青岛大学医学医疗中心项目签约。6月7日,青岛市西海岸新区与青岛大学携手共建的青岛大学医学医疗中心项目签约仪式隆重举行。青岛大学医学医疗中心项目位于青岛开发区王台片区,总占地面积约1113亩,分两期建设。其中,一期总投资约45亿元,主要按照三级甲等医院标准,规划建设1所“大专科、小综合”的青岛大学附属心血管病医院和1所口腔医院,计划2026年建成投用;二期总投资约22亿元,主要建设青岛大学基础医学院、口腔医学院、公共卫生学院等5个学院和22个研究院,计划2030年建成投用。
3.郑州大学第一附属医院领导班子调整。据河南省人民政府人事任免通知,近日,郭瑞霞(女)、朱长举两位专家被任命为郑州大学第一附属医院副院长。其中,郭瑞霞为医院妇产科主任医师,河南省妇科恶性肿瘤防治医学重点实验室主任,河南省妇科疑难疾病诊疗中心负责人,河南省妇科肿瘤生育力保护工程研究中心负责人,中华医学会妇科腹腔镜培训基地主任;朱长举为医院急诊外科副主任医师。


1. CDE新药受理情况(06月11日)



【泽璟制药】注射用ZGGS15临床试验申请获得FDA批准。
【诺思兰德】重组人肝细胞生长因子裸质粒注射液治疗Rutherford 5级(溃疡)严重下肢缺血性疾病III期临床试验完成240例受试者入组。
【贝达药业】伏罗尼布片(商品名:伏美纳)获得国家药监局批准上市。
- The End -





 个人中心
个人中心
 我是园区
我是园区




