21亿美元收购公司获得!诺和诺德IL-6单抗在华获批临床
收藏
关键词:
获批临床
资讯来源:医药观澜 + 订阅账号
发布时间:
2021-11-06
▎药明康德内容团队报道
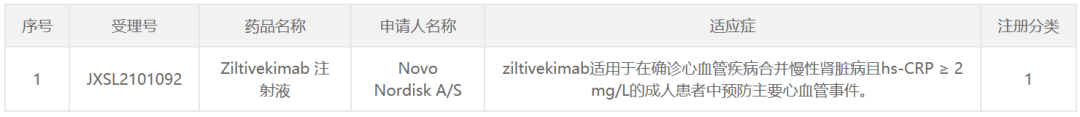
11月5日,中国国家药监局药品审评中心(CDE)公示显示,诺和诺德(Novo Nordisk)申报的1类新药ziltivekimab注射液已获得临床试验默示许可,拟开发用于:在确诊心血管疾病合并慢性肾脏病且高敏C反应蛋白(hs-CRP)≥2 mg/L的成人患者中预防主要心血管事件。这是一款全人源化IL-6单克隆抗体,诺和诺德于2020年6月以21亿美元收购Corvidia Therapeutics,接管了其主要候选药物ziltivekimab的开发工作。
心血管疾病是全球发病率和死亡率最高的疾病之一,且大约一半慢性肾病患者的死亡是由于与心血管疾病相关的并发症。hsCRP水平是慢性炎症的生物标志物,患者hsCRP水平升高说明心脏病发作或中风等心血管事件风险高。
公开资料显示,ziltivekimab是一种全人源化IL-6单克隆抗体,旨在通过抑制在动脉粥样硬化中起重要作用的促炎性细胞因子IL-6来降低全身炎症,从而降低慢性肾病患者的主要心血管不良事件风险。Ziltivekimab具有延长的半衰期,可以通过每月一次皮下注射给药。
Ziltivekimab曾是Corvidia Therapeutics公司主要候选药物。2020年6月,诺和诺德宣布
该公司,从而接管了ziltivekimab的开发工作。为此,诺和诺德将支付给Corvidia Therapeutics公司7.25亿美元前期付款,总计付款最终可能达到21亿美元。诺和诺德曾在新闻稿中表示,他们相信ziltivekimab有潜力成为“first-in-class”或“best-in-class”疗法,降低高风险患者人群的主要不良心血管事件风险。
2021年5月,诺和诺德在美国心脏病学会第70届年度科学会议上,
了ziltivekimab的2期临床试验结果。这是一项名为RESCUE的随机双盲、含安慰剂对照的2期临床试验,共入组264名受试者,旨在评估通过每月一次皮下注射ziltivekimab,是否在hs-CRP升高的晚期慢性肾病患者中安全有效地降低炎症生物标志物。
研究达到了试验的主要终点,接受治疗12周后,与安慰剂相比,ziltivekimab显著降低了中位hs-CRP水平,接受ziltivekimab 7.5mg,15mg和30mg的患者分别降低了77%,88%和92%(vs 4%)。此外,试验也达到了次要终点,与安慰剂相比,ziltivekimab使hs-CRP降低50%以上和hs-CRP水平低于2mg/L的患者比例显著升高,ziltivekimab 7.5mg,15mg和30mg的患者比例分别为66%,80%和93%(vs 4%)。另外,试验也观察到其他4种炎症生物标志物水平出现剂量依赖性的减少。
安全性方面,试验组与对照组出现的不良事件相似。Ziltivekimab耐受性普遍良好,没有发现意外的副作用。
基于这些结果,诺和诺德计划将ziltivekimab推进到大规模的心血管结果3期临床试验中,以进一步评估其潜力。根据clinicaltrials网站,目前该产品已启动一项3期临床试验,旨在比较ziltivekimab与安慰剂在心血管疾病、慢性肾脏疾病和炎症(ZEUS)患者中的作用。
此次ziltivekimab在中国获批临床,意味着该药也即将在中国开展相关临床试验。希望该产品在临床开发中进展顺利,早日为患者带来新的治疗选择。
参考资料:
[1]中国国家药监局药品审评中心. Retrieved Nov. 05,2021, from https://www.cde.org.cn/main/xxgk/listpage/9f9c74c73e0f8f56a8bfbc646055026d
[2] Novo Nordisk to acquire Corvidia Therapeutics and expand presence in cardiovascular disease. Retrieved June 11, 2020, from https://ml-eu.globenewswire.com/Resource/Download/e7e162e5-a2f3-4ff2-ab58-9ce1bdf9026f
[3] Ridker, P. M., et, al. (2021). IL-6 inhibition with ziltivekimab in patients at high atherosclerotic risk (RESCUE): a double-blind, randomised, placebo-controlled, phase 2 trial. The Lancet. Published. https://doi.org/10.1016/s0140-6736(21)00520-1
本文来自药明康德内容团队,欢迎个人转发至朋友圈,谢绝媒体或机构未经授权以任何形式转载至其他平台。转载授权请在「医药观澜」微信公众号留言联系我们。其他合作需求,请联系wuxi_media@wuxiapptec.com。
免责声明:药明康德内容团队专注介绍全球生物医药健康研究进展。本文仅作信息交流之目的,文中观点不代表药明康德立场,亦不代表药明康德支持或反对文中观点。本文也不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。







 个人中心
个人中心
 我是园区
我是园区




