
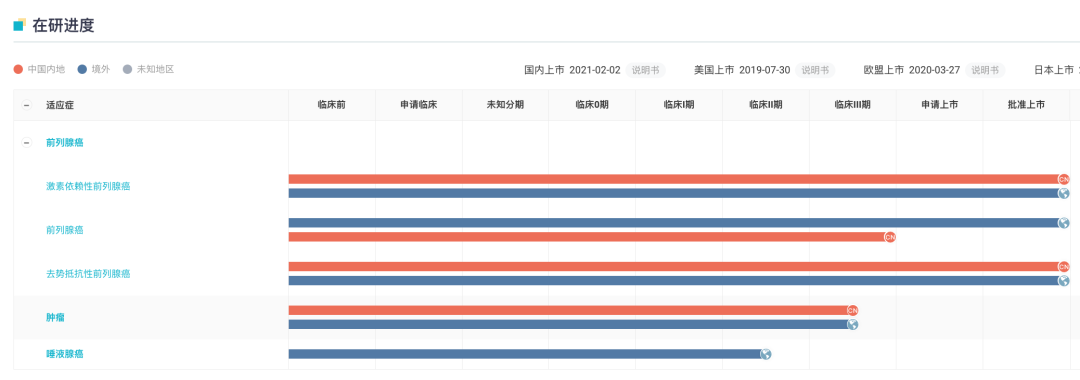
3 月 16 日,据 NMPA 官网显示,拜耳口服雄激素受体抑制剂(ARi)「达罗他胺片」新适应国内获批上市,联合多西他赛治疗转移性激素敏感性前列腺癌(mHSPC)成年患者(受理号:JXHS2200041)。


来自:NMPA 官网
此前,于 2021 年 2 月达罗他胺已在国内获批用于治疗有高危转移风险的非转移性去势抵抗性前列腺癌(NMCRPC)成年患者。
去年 8 月, 拜耳宣布,FDA 已批准其口服雄激素受体抑制剂(ARi)达罗他胺(darolutamide)联合多西他赛的补充新药申请(sNDA),用于转移性激素敏感性前列腺癌(mHSPC)患者的治疗。
此次 FDA 的批准基于一项 III 期 ARASENS 试验的积极结果。这是一项随机、3 期、多中心、双盲、安慰剂对照试验,旨在前瞻性地研究达罗他胺与化疗药物多西他赛和 ADT 疗法联合治疗 mHSPC 患者的安全性和有效性。
试验共纳入 1306 例新确诊患者。结果表明,与 ADT 加多西他赛相比,达罗他胺联合 ADT 和多西他赛可显著降低 32.5% 的死亡风险。
前列腺癌细胞的生长具有雄激素依赖性,故转移性前列腺癌患者最初对雄激素剥夺治疗(ADT)治疗敏感,即 mHSPC。持续 ADT 治疗后仍然疾病进展的患者会发展为转移性去势抵抗性前列腺癌(mCRPC)。
除了美国、中国大陆外,拜耳此前已向欧洲药品管理局(EMA)、日本厚生劳动省(MHLW)提交了申请,计划在全球范围内提交更多关于针对 mHSPC 适应症的监管申请。
在前列腺癌领域,拜耳开展了 6 项 III 期临床研究,包括当前尚未开始招募的 ARASAFE 研究以及 ALADDIN 研究。


来自:Insight 数据库
除前列腺癌外,当前拜耳正在探索达罗他胺其他适应症,如正在日本开展唾液腺癌的 II 期临床试验(登记号:NCT05694819)。
来自:Insight 数据库
达罗他胺是一种口服雄激素受体抑制剂,具有独特的化学结构,与雄激素受体高亲和力结合,表现出较强的拮抗活性,从而抑制受体功能和前列腺癌细胞的生长。该药由拜耳和 Orion 公司联合开发,当前已经在包括美国、欧盟、日本等在内的全球 70 多个国家和地区获得批准。
免责声明:本文仅作信息分享,不代表 Insight 立场和观点,也不作治疗方案推荐和介绍。如有需求,请咨询和联系正规医疗机构。
编辑:Hebe
PR 稿对接:微信 insightxb
投稿:微信 insightxb;邮箱 insight@dxy.cn
点击卡片进入 Insight 小程序
国内审评进度、全球新药开发…
随时随地查!

多样化功能、可溯源数据……
Insight 数据库网页版等你体验
点击阅读原文,立刻解锁!



 个人中心
个人中心
 我是园区
我是园区




