「 本文共:15条资讯,阅读时长约:3分钟 」


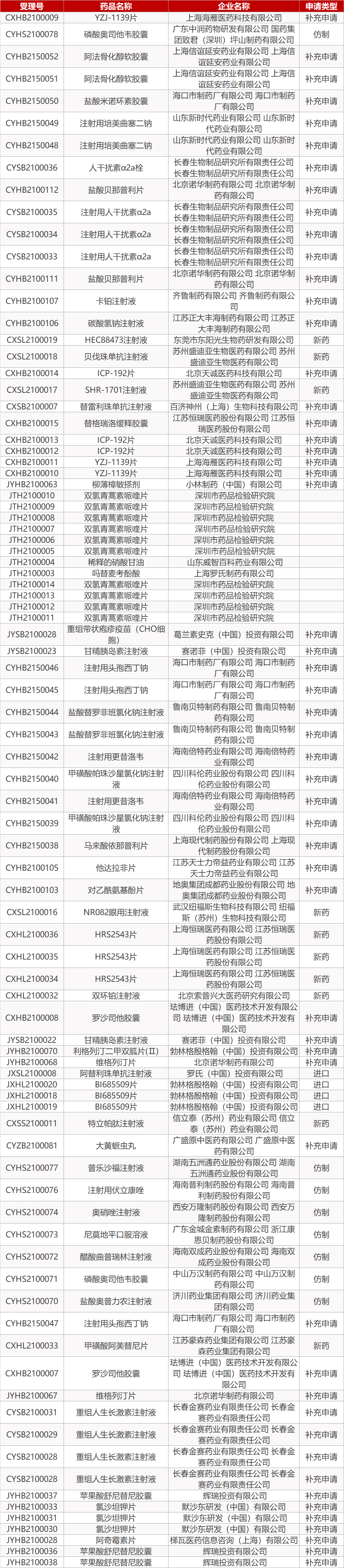
友芝友生物CD38/CD3双抗获批临床。友芝友生物研发的“注射用重组抗CD38和CD3双特异性抗体”(Y150)获国家药监局一项临床试验默示许可,临床适应症用于多发性骨髓瘤的治疗。Y150是国内首个获批临床的CD38/CD3双抗。相比于CD38单抗药物,Y150具有疗效好、不易产生耐药性、用药剂量小的优点。2020年8月,FDA已批准Y150在美国开展临床试验。


1.盐野义流感药Xofluza用于暴露后预防台湾获批。盐野义(Shionogi)制药内切核酸酶抑制剂Xofluza(baloxavir marboxil)的一份补充新药申请在台湾获得批准,用于接触过流感患者的12岁及以上人群,作为流感的预防性治疗用药。值得一提的是,Xofluza是获批用于暴露后预防的首款单剂量流感药物。此前,Xofluza已在台湾获批用于12岁及以上儿童和成人患者治疗A型和B型流感病毒急性感染。
2.宏业药业盐酸乐卡地平片通过一致性评价。宏业药业4类仿制药盐酸乐卡地平片获国家药监局批准上市并视同通过一致性评价,为该品种第二家通过一致性评价的产品。盐酸乐卡地平为第三代二氢吡啶类钙通道阻滞剂,临床适用于治疗轻、中度原发性高血压。米内网数据显示,2019年中国公立医疗机构及中国城市实体药店终端乐卡地平销售额接近3亿元。
3.复宏汉霖阿达木单抗新适应症申报上市。复宏汉霖阿达木单抗生物类似药汉达远(HLX03)用于治疗成人非感染性中间、后和全葡萄膜炎的补充上市申请(sNDA)获CDE受理。这是汉达远在中国境内递交的第4个适应症上市申请。去年12月,汉达远已获国家药监局批准上市,用于治疗类风湿关节炎、强直性脊柱炎和银屑病。值得一提的是,该新药其它新增适应症的补充申请也正在筹备中。
4.绿叶新冠中和抗体Ⅰ期临床完成受试者入组。绿叶旗下博安生物创新抗体疗法LY-CovMab在中国完成Ⅰ期临床的全部受试者入组。LY-CovMab是博安生物采用特殊的Fc序列设计,利用全人抗体转基因小鼠BA-hMab技术平台筛选出的新冠中和抗体,能有效避免ADE效应(抗体依赖的增强作用)发生,同时能有效应对病毒突变。临床前药效学研究结果显示:在治疗及预防SARS-CoV-2感染方面,LY-CovMab均具有良好疗效。
5.博雅辑因CRISPR/Cas 9基因编辑疗法获批临床。博雅辑因(EdiGene, Inc.)基因编辑治疗产品ET-01获国家药监局临床试验默示许可。ET-01是一款CRISPR/Cas9基因修饰BCL11A红系增强子的自体CD34+造血干祖细胞注射液,是自体的、体外基因编辑细胞治疗产品,拟开发用于输血依赖型β地中海贫血。该项临床研究将在不能接受常规干细胞移植的输血依赖型β地中海贫血患者中评价ET-01单次移植的安全性和有效性。据悉,ET-01也是国内首个获批临床的基因编辑疗法和造血干细胞产品。


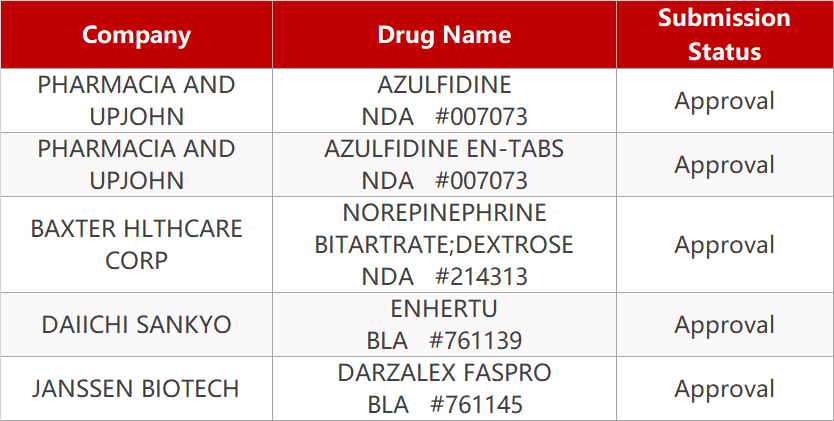
1.FDA批准强生Darzalex皮下制剂新适应症。强生旗下杨森Darzalex Faspro的新适应症获FDA批准,与硼替佐米(Bortezomib),环磷酰胺(Cyclophosphamide)和地塞米松联用,用于治疗新诊断出的轻链淀粉样变性的成年患者。这也是获FDA批准用于这类患者的首款疗法。Darzalex Faspro由daratumumab和透明质酸酶-fihj组成,是Darzalex的一种新的皮下注射(SC)制剂,已于去年5月获批用于治疗多发性骨髓瘤(MM)的4种治疗方案。
2.Arcus公司CD73抑制剂组合早期临床数据积极。Arcus Biosciences公司小分子CD73抑制剂AB680治疗转移性胰腺癌的Ⅰ/Ⅰb期临床ARC-8获积极初步数据。与化疗和抗PD-1抗体联用,一线治疗胰腺癌达到41%(7/17)的客观缓解率,优于标准疗法的历史表现。在接受药物治疗超过16周的患者中,组合疗法达到85%(11/13)的疾病控制率。目前,在前3个剂量递增队列的可评估患者中,10/12例(83%)仍在继续治疗,中位治疗时间为180天。
3.Dompe公司1型糖尿病新药启动Ⅲ期临床。Dompe公司新型口服CXCL-8抑制剂ladarixin治疗新发1型糖尿病(T1D)的Ⅲ期临床首例患者入组。该项研究入组患者为有较低残余β细胞功能的新发T1D青少年和成人患者,旨在评估通过抑制CXCL-8(IL-8)的生物学活性来维持β细胞功能的有效性。T1D是一种慢性自身免疫性疾病,随着免疫介导的胰腺β细胞功能的丧失,将导致症状性糖尿病和终身胰岛素依赖。
4.Five Prime公布其胃癌创新疗法最新临床结果。Five Prime公司在ASCO GI 2021会议上公布“first-in-class”FGFR2b单抗bemarituzumab一线治疗FGFR2b+、非HER2+、晚期胃或胃食管连接部(GEJ)癌患者Ⅱ期临床研究FIGHT的阳性结果。结果显示,与安慰剂联合化疗相比,bemarituzumab联合化疗显著改善了无进展生存期(中位PFS:9.5个月vs7.4个月)、总生存期(中位OS:未达到vs12.9个月)、总缓解率(ORR:46.8%vs33.3%)。再鼎医药拥有bemarituzumab在大中华区开发和商业化的独家许可。
5.Steba公司免疫光激活癌症疗法获FDA快速通道资格。FDA授予Steba biotech公司免疫光激活癌症疗法padeliporfin ImPACT(由非活性药物padeliporfin和光传递系统组成)治疗低度和单灶高度上尿路上皮癌(UTUC)成人患者的快速通道资格(FTD)。ImPACT是一种创新、微创、靶向的肿瘤学治疗平台,已在欧洲、以色列获批用于治疗早期前列腺癌患者。该公司预计将于今年第一季度启动padeliporfin ImPACT用于治疗低度UTUC患者的关键Ⅲ期临床。
6.Biohaven发布Troriluzole阿尔兹海默病项目最新结果。Biohaven pharmaticals第三代在研药物troriluzole(谷氨酸调节剂利鲁唑的前药配方)治疗轻中度阿尔兹海默病(AD)的Ⅱ/Ⅲ期临床未达主要和关键次要终点。通过AD评估量表认知亚量表11(ADAS cog)、临床痴呆评定量表汇总和分析,与安慰剂组相比,troriluzole治疗组在48周时患者没有显示出统计学上的改善;在整个人群中通过MRI评估海马体积,troriluzole与安慰剂组相比也没有区别。但在一项由轻度AD患者组成的亚组分析中,troriluzole组患者的ADAS cog和海马容积MRI显示出临床改善,但不具统计学意义。Biohaven计划修正该项研究的长期扩展研究。


1.131位一线抗疫医护直接评高级职称。江苏省人社厅1月17日发布消息,在刚刚结束的江苏省2020年度高层次和急需紧缺人才高级职称考核认定中,131位疫情防控一线医务人员被直接认定为高级职称。这131人中有紧急驰援湖北的医护人员,也有坚守江苏防控一线的医护人员。在抗击新冠肺炎疫情的战斗中,他们中有2人受到中央表彰、129人受到江苏省委省政府表彰。
2.华西医学入驻海南博鳌乐城先行区。华西乐城医院项目开工仪式18日在海南博鳌乐城国际医疗旅游先行区举行。该项目建成后,将引入四川大学华西医学15个高端诊疗中心。据悉,此次华西医学整体进驻乐城,囊括华西医院、华西第二医院、华西第四医院和华西口腔医院等4家医院。华西乐城医院总建筑面积约65600平方米,计划2022年9月完工。
3.英媒:八分之一“康复”新冠患者在140天内死亡。据英国《太阳报》18日消息,一项研究发现,已“康复”出院的新冠肺炎患者中,有八分之一的人会在140天内死亡。根据莱斯特大学和国家统计局调查数据,在英国第一批出院的47780人中,有29.4%的人在140天内重回医院,其中12.3%的人死亡。英媒称,新冠肺炎长期影响会导致患者出现心脏问题、糖尿病和慢性肝肾类疾病。


【海思科】全资子公司辽宁海思科的脂肪乳氨基酸(17)葡萄糖(11%)注射液通过一致性评价。
【葫芦娃】公司的长春西汀注射液获得《药品注册证书》。
【片仔癀】2020年实现营收约65.1亿元,同比增长13.72%;归母净利润约16.7亿元,同比增长21.27%;扣非归母净利润约16.1亿元,同比增长19.11%。


- The End -




 个人中心
个人中心
 我是园区
我是园区




