▎药明康德内容团队编辑

9月份,预计FDA将就以下四种药物做出是否批准决定,详见下表。
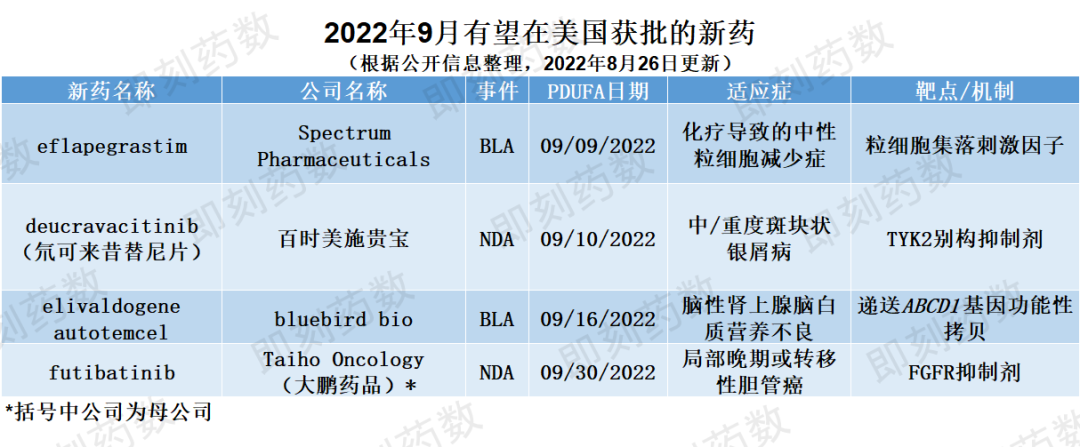
▲
9月有望在美国获批的新药(药明康德内容团队制图,点击可见大图)
药物名称:deucravacitinib(氘可来昔替尼片)
百时美施贵宝的deucravacitinib是一种口服、选择性酪氨酸激酶2(TYK2)别构抑制剂,正在寻求FDA批准,用于治疗成人中/重度斑块状银屑病。该药物具有独特的作用机制,通过与TYK2的调节结构域结合,实现高度选择性。在治疗剂量下,该药不会抑制JAK1、JAK2或JAK3。向美国FDA提交的新药申请(NDA)是基于两项关键性3期临床试验,结果显示,与安慰剂和对照药物相比,deucravacitinib在皮肤症状清除率、症状负担和生活质量指标方面表现出显著且具有临床意义的改善,并且耐受性良好。该药物的NDA于2021年11月被FDA接受,PDUFA目标日期为2022年9月10日。
最近公布的
数据分析
进一步表明,deucravacitinib的临床疗效在两年的研究中持续保持。在试验第60周,77.7%的受试者银屑病面积和严重程度指数改善至少75%,58.7%的受试者在静态医师全面评估中达到皮肤症状完全清除或几乎清除。全球至少有1亿人受到银屑病的影响,其中有近四分之一为中重度银屑病患者。如果获得批准,deucravacitinib有望成为首款获FDA批准上市的TYK2抑制剂,为这一广泛流行的免疫介导疾病患者提供新的治疗选择。
药物名称:eflapegrastim
公司名称:Spectrum Pharmaceuticals
适应症:化疗导致的中性粒细胞减少症
Spectrum公司的eflapegrastim是一种长效的粒细胞集落刺激因子(G-CSF),用于治疗化疗诱导的中性粒细胞减少症。该药物通过结合在粒细胞祖细胞上表达的G-CSF受体来刺激其增殖过程,使其最终在骨髓中产生功能性活化的嗜中性粒细胞。在共入组了643例早期乳腺癌患者的两项3期临床试验中,与对照药物相比,eflapegrastim在缩短化疗诱导的重度中性粒细胞减少症持续时间方面具有非劣效性;其中,3期临床试验ADVANCE的结果显示,eflapegrastim使罹患重度中性粒细胞减少症的绝对风险降低了8.5%。FDA于2022年4月接受其生物制品许可申请(BLA),PDUFA日期设定为9月9日。化疗引起的中性粒细胞减少症可能会导致患者化疗药物剂量降低或治疗延迟,从而影响临床疗效,还可能出现严重感染等并发症,甚至会导致死亡。如果得到批准,eflapegrastim将成为20多年来首款获FDA批准的新型长效G-CSF,有望降低患者因中性粒细胞减少导致感染甚至死亡的风险。
药物名称:elivaldogeneautotemcel
bluebird bio的elivaldogene autotemcel是一种一次性基因疗法,用于治疗18岁以下携带ABCD1基因突变的早期脑性肾上腺脑白质营养不良(CALD)患者。Elivaldogene autotemcel利用Lenti-D慢病毒载体,在体外将ABCD1基因的功能性拷贝导入到患者自身的造血干细胞中,再输回到患者体内产生ALD蛋白,从而促进极长链脂肪酸的分解。在关键性2/3期临床试验ALD-102中,90%的CALD患者达到第24个月无主要功能障碍(MFD)的生存终点,并且大多数患者的神经功能得以维持。
FDA于2022年1月接受BLA并授予其优先审评资格,PDUFA目标日期为2022年9月16日。
该疗法还在美国获得孤儿药资格、突破性疗法认定以及罕见儿科疾病认定。
CALD可迅速导致进行性、不可逆的神经功能丧失和死亡,目前唯一可用的治疗选择是接受同种异体造血干细胞移植。然而据估计,超过80%CALD患者的兄弟姐妹中没有匹配的供体。如果获得批准,elivaldogeneautotemcel将成为FDA批准的首个针对
CALD
的基因疗法,治疗作用有望终身有效,且无需来自他人的造血干细胞移植。
药物名称:futibatinib
公司名称:TaihoOncology
适应症:局部晚期或转移性胆管癌
日本大鹏药品(Taiho Pharmaceutical)子公司Taiho Oncology的futibatinib是一款选择性不可逆FGFR1、2、3、4口服小分子抑制剂,正在寻求FDA批准,用于治疗携带FGFR2基因重排(包括基因融合)的局部晚期或转移性胆管癌经治患者。Futibatinib通过与FGFR1-4的ATP结合“口袋”不可逆地共价结合,抑制FGFR介导的信号传导,从而降低携带FGFR1-4基因变异的肿瘤细胞的增殖。在入组了103例患者的关键性2b期临床试验中,futibatinib达到了试验的主要和次要终点,其客观缓解率(ORR)为41.7%,中位缓解持续时间(DOR)为9.5个月,74%获得缓解的患者DOR超过6个月。FDA于2022年3月接受了NDA并授予其优先审评资格,PDUFA日期为9月30日。该药物还在美国获得突破性疗法认定。局部晚期和转移性胆管癌无法通过手术完全切除,目前的标准治疗选择主要为化疗、放疗、肝移植,患者预后不良。如果获得批准,futibatinib有望成为这类患者人群潜在“best-in-class”的治疗选择。
参考资料:
[1] Spectrum Pharmaceuticals Announces FDA Acceptance of BLA Resubmission for Eflapegrastim. Retrieved August24, 2022 from,https://investor.sppirx.com/news-releases/news-release-details/spectrum-pharmaceuticals-announces-fda-acceptance-bla
[2] Bristol Myers Squibb’s Applications for Deucravacitinib for the Treatment of Moderate to Severe Plaque Psoriasis Accepted by U.S. Food and Drug Administration and Validated by European Medicines Agency. Retrieved August 24, 2022 from, https://www.businesswire.com/news/home/20211129005192/en/Bristol-Myers-Squibb%E2%80%99s-Applications-for-Deucravacitinib-for-the-Treatment-of-Moderate-to-Severe-Plaque-Psoriasis-Accepted-by-U.S.-Food-and-Drug-Administration-and-Validated-by-European-Medicines-Agency
[3] bluebird Provides Update on FDA Review Timelines for Betibeglogene Autotemcel (beti-cel) for Beta-Thalassemia and Elivaldogene Autotemcel (eli-cel) for Cerebral Adrenoleukodystrophy (CALD). Retrieved August 24, 2022 from, https://www.businesswire.com/news/home/20220118005544/en/bluebird-Provides-Update-on-FDA-Review-Timelines-for-Betibeglogene-Autotemcel-beti-cel-for-Beta-Thalassemia-and-Elivaldogene-Autotemcel-eli-cel-for-Cerebral-Adrenoleukodystrophy-CALD
[4] TAIHO ONCOLOGY ANNOUNCES UPDATED EFFICACY AND SAFETY DATA FOR FUTIBATINIB IN CHOLANGIOCARCINOMA AT 2022 ASCO ANNUAL MEETING. Retrieved August 24, 2022 from, https://www.taihooncology.com/us/news/2022-06-03_asco_2022_press_release/
本文来自药明康德内容团队,欢迎个人转发至朋友圈。转发授权请在「医药观澜」微信公众号留言联系我们。其他合作需求,请联系wuxi_media@wuxiapptec.com。
免责声明:药明康德内容团队专注介绍全球生物医药健康研究进展。本文仅作信息交流之目的,文中观点不代表药明康德立场,亦不代表药明康德支持或反对文中观点。本文也不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。










 个人中心
个人中心
 我是园区
我是园区





