FDA批准首个基于NGS技术的液体活检产品,标志着突变检测新时代的到来!
收藏
关键词:
FDA批准FDA
资讯来源:菁良 + 订阅账号
发布时间:
2020-08-26
利用血液作为标本来源检测获取肿瘤的相关信息,是一种简单且非侵入性的组织活检替代方法,我们也称之为液体活检,它也具有患者依从性好,特异性好,异质性低,可反复取材等优势。
2020年8月7日,美国FDA批准Guardant Health公司开发的液体活检Guardant 360 CDx用于所有实体瘤类型的综合基因组分析。同时,FDA还批准其为奥希替尼(osimertinib)的伴随诊断产品,通过血液检测进而识别受益于奥希替尼治疗的EGFR突变(L858R/19Del/T790M)的非小细胞肺癌患者。
FDA设备与放射健康中心体外诊断与放射健康办公室主任Tim Stenzel博士表示:“液体活检以及NGS技术伴随诊断的批准标志着突变检测的新时代”。“患者除了从侵入性较小的检测中受益之外,还能同时获得基因组改变的多个生物标志物,而不是一次仅检测一个生物标志物。这可以缩短患者开始治疗的等待时间,并深入了解可能的耐药机制”
Guardant360 CDx检测主要利用两种技术。第一种为液体活检,其利用血液样本为专业医护人员提供有关患者肿瘤的遗传信息。与标准组织活检相比,它具有较小的侵入性、易于重复,在由于肿瘤的位置而无法进行标准组织活检的情况下,可以使用液体活检。第二种技术是NGS,其使用大panel基因测序技术进行高通量肿瘤分析,帮助临床医生更高效、全面的进行评估诊断,从而为患者提供更好的诊断治疗。
血液检测将会取代侵入性组织活检作为一种无痛的方法来确认肿瘤和指导治疗。简单的抽血便可以帮助癌症患者获得正确的药物!
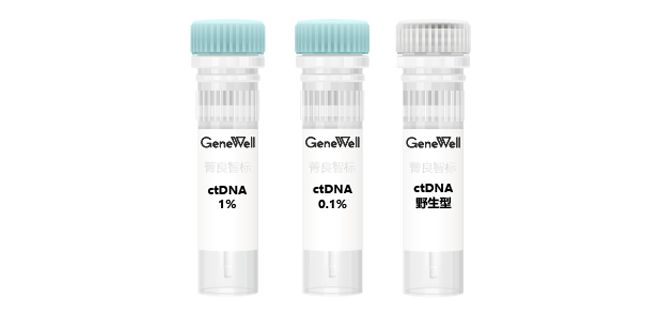
菁良基因研发了一系列细胞系来源的ctDNA参考标准品,最大程度模拟患者样本,可以帮助开发、优化、监测和控制检测的准确性。
这些标准品包含一系列关键癌症基因中常用突变位点,产品平均片段分布在160bp左右,能最大程度接近真实血浆ctDNA片段分布。
♢ 样本来源于人类细胞系
♢ 变异位点频率经过数字PCR平台验证
♢ 套装包含三管产品,对应三个AF梯度:0,0.1%,1%♢ 涵盖8个非小细胞肺癌热门基因突变位点
♢ 标准品平均片段长度为160bp,最大程度模拟循环肿瘤DNA片段分布
参考资料:
1.Guardant Health Guardant360® CDx First FDA-Approved Liquid Biopsy for Comprehensive Tumor Mutation Profiling Across All Solid Cancers
https://investors.guardanthealth.com/news-releases/news-release-details/guardant-health-guardant360r-cdx-first-fda-approved-liquid
2. FDA Approves First Liquid Biopsy Next-Generation Sequencing Companion Diagnostic Test
https://www.fda.gov/news-events/press-announcements/fda-approves-first-liquid-biopsy-next-generation-sequencing-companion-diagnostic-test
识别关注菁良微信账号
更多精彩内容与您分享
邮箱:info@gene-well.com
网站:www.gene-well.com
技术支持热线:0755-25167062



 个人中心
个人中心
 我是园区
我是园区