
导读:PDA是一种高致死性的恶性肿瘤,发病率增加,预后效果不良,因而需要为胰腺导管腺癌(PDA)开发有效的治疗方法。十多年来,尽管靶向肿瘤代谢一直是深入研究的重点,但肿瘤代谢可塑性和毒性风险限制了这种抗癌策略的发展。
近日,波士顿儿童医院、麻省理工学院和哈佛大学的研究人员合作在知名期刊《Nature》发表研究论文“Ornithine aminotransferase supports polyamine synthesis in pancreatic cancer”,研究发现PDA对谷氨酰胺的从头鸟氨酸合成具有明显的依赖性,这为治疗胰腺癌患者提供了一个毒性最小的机具吸引力的治疗窗口。

https://www.nature.com/articles/s41586-023-05891-2
研究背景
01
在过去二十年中,关于新癌症治疗方法的大部分研究都集中在遗传靶点上,这些靶点通过改变细胞信号传导或关闭肿瘤抑制因子来允许癌症生长和扩散。然而,越来越多的证据表明,癌细胞代谢的独特特征可以为开发直接影响肿瘤的治疗方法提供新的机会,同时保持健康细胞相对不受影响。
胰腺癌是所有常见恶性实体瘤中预后最差的,5年总生存率约为10%。大约95%的胰腺癌是外分泌细胞肿瘤,最常见的是胰腺导管腺癌(PDAC)。PDAC的高死亡率对临床医生提出了4个重要挑战。首先,胰腺位于上腹部深处胃的后方及主动脉及其上腹部主要分支之间,导致进展中的肿瘤不易被发现,肿通常生长在血管周围并包绕这些血管导致仅有15%到20%的肿瘤可以接受手术切除。第二,PDAC表现出早期转移的侵袭性生物学特征,超过50%的患者确诊时表现已出现远处转移,大多数接受切除手术的患者也会在术后4年内发生转移,这表明在有局限期患者体内已存在微转移灶。第三,PDAC的生理作用会极大地降低病人的体能状态,限制高强度治疗耐受性。确诊时高达80%的患者存在恶病质,这可因胰腺外分泌和内分泌功能障碍进一步恶化。最后,PDAC对多种抗肿瘤治疗表现出耐药性,即使给予有效的全身药物治疗和放疗,仍会迅速进展,且病理学完全应答率低。实际上仅有不到3%的转移性疾病患者存活时间超过5年,而这一数字在局限性 I A 期患者中上升到70%以上。由此得出PDAC的生存预后不良因素:T分期晚,高组织学分级,淋巴结转移或远处转移,切除后有无肉眼或显微镜下的残留病变,侵及主要血管及体能状态差。
在本研究中,研究人员发现胰腺导管腺癌是一种极具侵袭性的癌症,它使用一种独特的代谢途径,而正常生长的成体细胞很少使用这种途径来获取和产生营养。这种途径需要一种称为鸟氨酸氨基转移酶或OAT的酶,它可以为开发专门针对PDA的新疗法提供机会,并且副作用很小。为了支持它们的生长,胰腺肿瘤必须制造大量称为多胺的化合物。大多数细胞使用依赖精氨酸的过程来制造它们所需的多胺。然而,胰腺肿瘤的微环境通常缺乏精氨酸。
研究结果
02
“癌症通过使用OAT制造多胺来克服具有挑战性的精氨酸耗尽微环境,”Kalaany解释说。“如果我们靶向OAT,我们就可以抑制肿瘤生长。”
为了验证这一想法,研究小组试图在细胞和小鼠模型中阻断OAT,包括遗传(通过敲低其表达)和一种名为5-FMO(一种已知的OAT抑制剂)的药物。代谢和细胞生长研究表明,这两种方法都抑制了两种模型系统中的癌症生长。
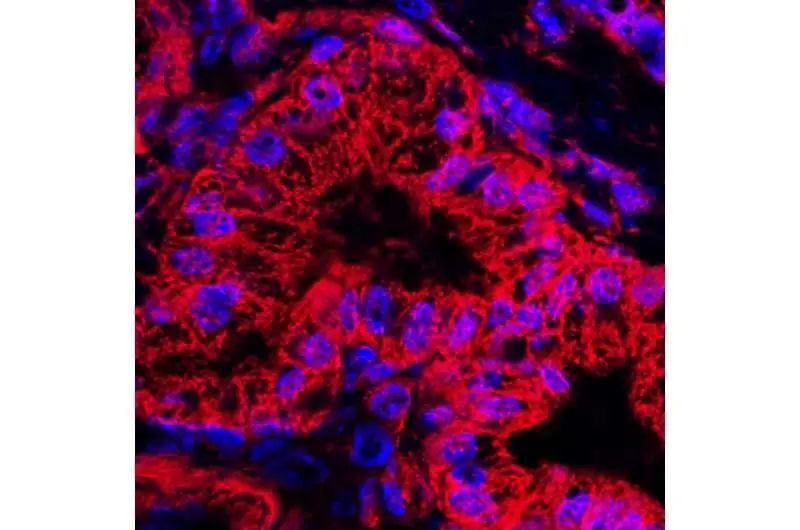
来自人胰腺导管癌小鼠模型的异常胰管的线粒体染色(红色)和核染色(蓝色)。
研究人员发现这个过程通过鸟氨酸氨基转移酶(OAT)介导,支持多胺合成,是肿瘤生长所必需的。这种定向OAT活性通常主要局限于婴儿期,与大多数成人正常组织和其他癌症类型依赖精氨酸衍生的鸟氨酸进行多胺合成形成对比。这种依赖性与PDA肿瘤微环境中的精氨酸耗竭有关,并由突变的KRAS驱动。活化的KRAS诱导OAT和多胺合成酶的表达,导致PDA肿瘤细胞中转录组和开放染色质景观的改变。PDA的明显依赖性,但不是正常组织,对OAT介导的从头鸟氨酸合成,为治疗胰腺癌患者提供了一个有吸引力的治疗窗口,毒性最小。
研究意义
03
Clish说:“从本质上讲,我们想要一种针对癌细胞主要使用的酶的化合物,这样你就可以以最小的副作用来打击它。事实上,胰腺癌细胞而不是大多数正常成年细胞对OAT产生它们所需的代谢物多胺有这种依赖性,这表明它是一个可以利用的潜在目标。”
Kalaany指出,这些发现为胰腺癌治疗增加了另一种潜在的选择,5-FMO已经在实验中用于其他目的,同时她也看到了将研究结果转化为临床的巨大潜力。
参考资料:
https://medicalxpress.com/news/2023-04-unique-metabolic-pathway-starve-pancreatic.html
https://www.nature.com/articles/s41586-023-05891-2




 个人中心
个人中心
 我是园区
我是园区




