
越来越多的研究表明,神经系统与免疫系统存在紧密的互作关系【1,2】。作为神经系统的重要组成部分,GABA系统包括GABA、GABA受体、谷氨酸脱羧酶(GAD)及GABA转运载体(GAT)等。多种免疫细胞表达GABA系统相应组分,例如巨噬细胞表达GAD和GABA受体,T细胞表达GAD、GAT和GABA受体【3,4】。GABA系统对免疫细胞命运具有重要的影响,目前关于GABA系统(特别是GAT)免疫调控作用的研究多集中于T细胞,如GAT1缺失增强T细胞介导的免疫反应,GAT2缺失促进肠道感染时Th17细胞的分化【4-6】;然而,天然免疫细胞(如巨噬细胞)是否表达GAT及其对天然免疫细胞命运的影响仍值得进一步研究。
巨噬细胞作为机体免疫防御的首道防线具有高度多样性和可塑性,可应对外界不同刺激以发挥不同的功能【7,8】。例如,在促炎信号的刺激下(如细菌脂多糖LPS和/或干扰素-γ),巨噬细胞极化为M1型,表现为促炎表型并分泌大量的促炎细胞因子(特别是白介素-1),具有杀菌和抗肿瘤活性。然而,巨噬细胞表型障碍(如巨噬细胞促炎表型的长期激活)与一系列疾病的发生发展有关,包括脓毒血症、感染性疾病和肥胖等【9-11】。因此,从不同层面(外界刺激、胞内信号和细胞代谢等)精准调控巨噬细胞极化显得尤为关键。然而,对于GABA系统,特别是GAT,是否调控巨噬细胞命运是未知的。
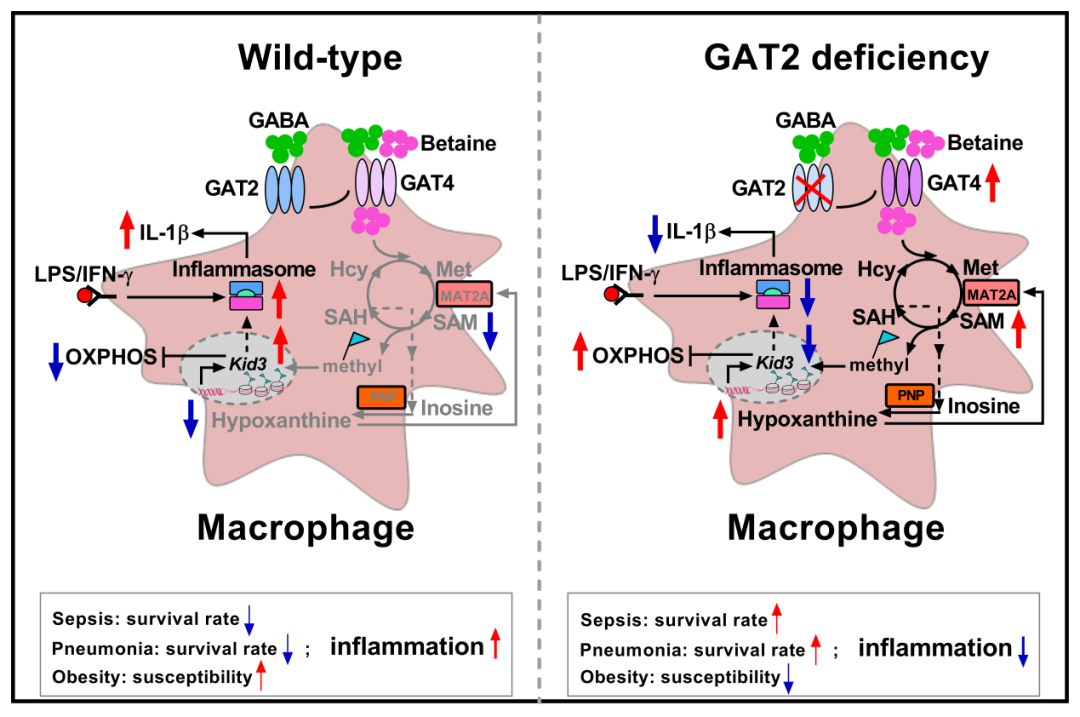
近日,华南农业大学任文凯团队在Science Advances杂志上发表了一篇题为GABA transporter sustains IL-1β production in macrophages的文章,揭示了巨噬细胞表达GAT2,并且GAT2通过代谢和表观机制调控M1型巨噬细胞极化,并影响相关炎性疾病的发生发展。

研究人员首先发现小鼠原代腹腔巨噬细胞高表达Slc6a13(编码GAT2)和Slc6a12(编码GAT4),此外,LPS/IFN-γ刺激影响腹腔巨噬细胞GAT2和GAT4的表达,提示GAT2和/或GAT4影响巨噬细胞的活化。鉴于GAT2转运GABA,而GAT4转运GABA和甜菜碱(betaine),因此研究人员后期研究主要集中在GAT2。
研究人员构建了GAT2敲除小鼠,发现GAT2缺失不影响静息状态巨噬细胞的数量、炎性因子的分泌以及NF-κB的活化,但是显著抑制了基础NLRP3炎性小体的活化。更为重要的是,GAT2缺失抑制了M1型巨噬细胞IL-1β的产生和M1型巨噬细胞中NLRP3炎性小体的活化。通过转录组分析和Seahorse细胞能量代谢仪检测,GAT2缺失促进了胞内氧化磷酸化(OXPHOS)(与促炎巨噬细胞功能负相关【12】)。
胞内代谢状态与巨噬细胞的功能密切相关【13】,通过GC-3Q-MS检测发现GAT2缺失重塑了静息状态和促炎状态巨噬细胞的胞内代谢。通过差异代谢物回补发现,次黄嘌呤(hypoxanthine)显著降低了WT巨噬细胞IL-1β的产生,抑制炎性小体的活化并增强OXPHOS能力。进一步通过代谢机制解析,研究人员发现巨噬细胞GAT2的缺失可以代偿性增加GAT4的表达,提高胞内betaine的含量进而导致胞内hypoxanthine积累。
在机制解析上,研究人员筛选并验证了关键转录因子KID3在调节OXPHOS和NLRP3炎性小体相关基因表达的作用。经过代谢组学分析发现胞内hypoxanthine的代谢变化伴随着胞内S-腺苷甲硫氨酸(SAM)含量的改变。更为重要的是hypoxanthine可以直接与MAT2A结合,以利于胞内SAM积累。以上结果提示上述事件与细胞甲基化水平的变化密切相关,研究人员通过MassARRAY甲基化检测等技术手段证明了以上假设。
综上所述,这项工作阐明了GAT介导的胞内betaine/SAM/hypoxanthine代谢通路影响转录因子KID3的甲基化,抑制NLRP3-ASC-Caspase-1复合体的形成、提高胞内OXPHOS水平,进而抑制M1型巨噬细胞IL-1β的产生。该研究结果丰富了免疫代谢理论,同时也为干预巨噬细胞相关疾病的发生发展提供了新的策略。
华南农业大学动物科学学院的博士研究生夏耀耀和西南大学动物医学院的博士研究生何芳为本文的共同第一作者,华南农业大学动物科学学院任文凯教授是本文的通讯作者。
原文链接:
https://advances.sciencemag.org/content/7/15/eabe9274
参考文献
1 Lai, N. Y. et al. Gut-Innervating Nociceptor Neurons Regulate Peyer's Patch Microfold Cells and SFB Levels to Mediate Salmonella Host Defense. Cell 180, 33-49.e22, doi:10.1016/j.cell.2019.11.014 (2020).
2 Jarret, A. et al. Enteric Nervous System-Derived IL-18 Orchestrates Mucosal Barrier Immunity. Cell 180, 813-814, doi:10.1016/j.cell.2020.02.004 (2020).
3 Kim, J. K. et al. GABAergic signaling linked to autophagy enhances host protection against intracellular bacterial infections. Nature communications 9, 4184, doi:10.1038/s41467-018-06487-5 (2018).
4 Ren, W. K. et al. Slc6a13 deficiency promotes Th17 responses during intestinal bacterial infection. Mucosal Immunol. 12, 531-544, doi:10.1038/s41385-018-0111-7 (2019).
5 Dionisio, L., Rosa, M. J. D., Bouzat, C. & Esandi, M. D. C. An intrinsic GABAergic system in human lymphocytes. Neuropharmacology 60, 513-519 (2011).
6 Wang, Y. et al. Gamma-aminobutyric acid transporter 1 negatively regulates T cell-mediated immune responses and ameliorates autoimmune inflammation in the CNS. Journal of immunology (Baltimore, Md. : 1950) 181, 8226-8236, doi:10.4049/jimmunol.181.12.8226 (2008).
7 Locati, M., Curtale, G. & Mantovani, A. Diversity, Mechanisms, and Significance of Macrophage Plasticity. Annual review of pathology 15, 123-147, doi:10.1146/annurev-pathmechdis-012418-012718 (2020).
8 Weichhart, T., Hengstschläger, M. & Linke, M. Regulation of innate immune cell function by mTOR. Nature reviews. Immunology 15, 599-614, doi:10.1038/nri3901 (2015).
9 Martínez-García, J. J. et al. P2X7 receptor induces mitochondrial failure in monocytes and compromises NLRP3 inflammasome activation during sepsis. Nature communications 10, 2711, doi:10.1038/s41467-019-10626-x (2019).
10 Langston, P. K. et al. Glycerol phosphate shuttle enzyme GPD2 regulates macrophage inflammatory responses. Nature immunology 20, 1186-1195, doi:10.1038/s41590-019-0453-7 (2019).
11 Jaitin, D. A. et al. Lipid-Associated Macrophages Control Metabolic Homeostasis in a Trem2-Dependent Manner. Cell 178, 686-698.e614, doi:10.1016/j.cell.2019.05.054 (2019).
12 O'Neill, L. A. J., Kishton, R. J. & Rathmell, J. A guide to immunometabolism for immunologists. Nat. Rev. Immunol. 16, 553-565, doi:10.1038/nri.2016.70 (2016).
13 Murray, P. J., Rathmell, J. & Pearce, E. SnapShot: Immunometabolism. Cell metabolism 22, 190-190.e191, doi:10.1016/j.cmet.2015.06.014 (2015).
(可上下滑动阅览)
转载须知
【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经允许禁止转载,作者拥有所有法定权利,违者必究。




 个人中心
个人中心
 我是园区
我是园区




