用未来的视角,对中国生物工艺与工程做今天的展望!



TIL疗法作为一项个体化细胞疗法,生产流程复杂,监管对生产工艺的要求也十分严格。
Iovance的BLA进程在过去两年一再延期也是因为其效力检测方法等工艺方法没有达到FDA要求。近期Lifileucel的BLA完成递交标志着FDA认可了TIL疗法能够作为一款商业化药物进行生产,这是TIL疗法产业化的一项重要里程碑。
Lifileucel在末线无药可救的黑色素瘤患者中实现了约30%的ORR,其中将近一半的反应患者疾病缓解可以维持超过24个月,极大延长这部分患者的生存时间,证明了TIL是一款有效的实体瘤治疗手段。近年,海外的一系列临床试验也进一步验证了TIL疗法与PD-1联用成为作为一线疗法的可能。Iovance已经启动了头对头与PD-1在一线恶性黑色素瘤、非小细胞肺癌的对比试验,我们有望在未来两年看到更多TIL的亮眼数据读出。
沙砾生物的GT101是国内首款获批注册临床的TIL疗法,目前正在临床一期试验中。GT201和GT316作为沙砾自研的基因编辑型TIL管线,在TIL细胞功能上进行了优化,潜在进一步提高疗效。在临床试验中,我们的TIL疗法已经在包括宫颈癌、黑色素瘤在内的多个实体瘤中产出疗效,多例末线患者疾病得到缓解。我们的试验正在北京、上海、成都、重庆、等多个城市的医院开展,希望加入TIL临床试验的宫颈癌、非小细胞肺癌、黑色素瘤等实体瘤患者可以与我们联系。
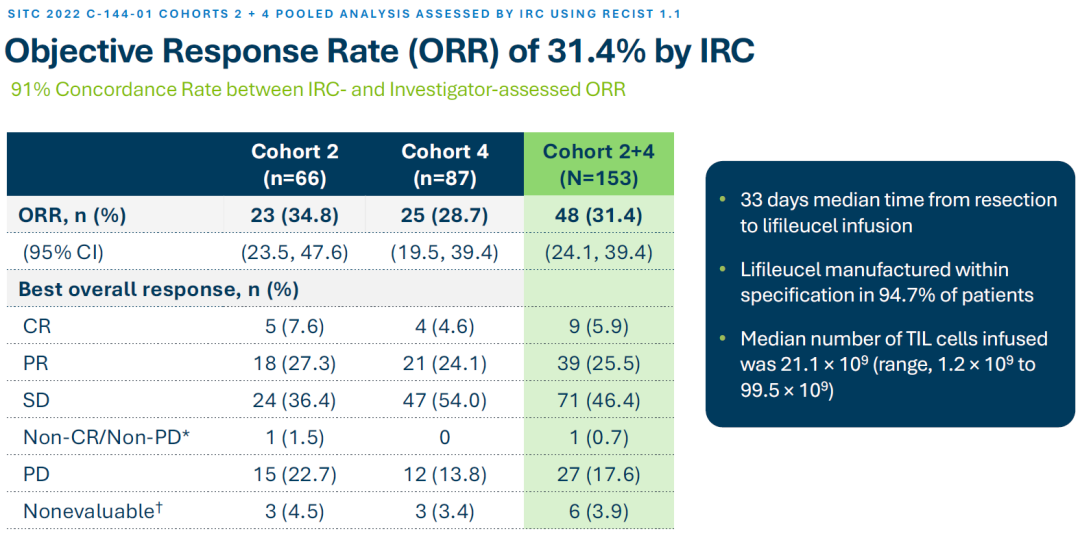
此次Lifileucel的BLA基于C-144-01临床研究的数据。队列2和4合并患者(n=153)的ORR为31%,并且在中位研究随访27.6个月时未达到中位DOR。
具体看,在注册性队列4(n=87)中,试验组的客观缓解率(ORR)为29%,3例完全缓解(CR),22例部分缓解(PR)。中位缓解持续时间(DOR)为10.4个月,中位随访时间为23.5个月。
队列2(n=66)研究结果也证实Lifileucel的疗效,其中ORR为35%,5例CR和18例PR。队列2的中位DOR未达到,中位随访时间为36.6个月。
Iovance正在寻求Lifileucel的加速获批上市。目前,Iovance还与FDA就III期临床TILVANCE-301设计达成协议,这项研究旨在评估Lifileucel联合pembrolizumab一线治疗晚期黑色素瘤患者的疗效,以支持Lifileucel的完全获批。
作为一种TIL疗法,Lifileucel的治疗过程需要从肿瘤中分离浸润的淋巴细胞,体外扩增后回输给患者,而患者抗原特异性的TIL细胞,可以特异性识别患者的癌细胞进行杀伤。
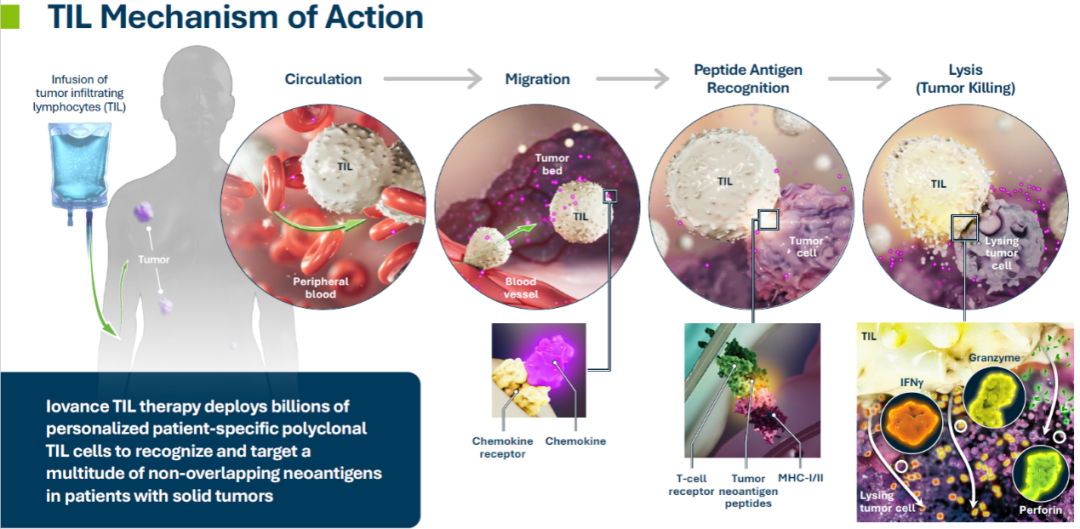
跟当下火热的CAR-T疗法相比,TIL疗法有望避免实体瘤的特异性抗原少、异质性及肿瘤微环境等前者遇到的挑战,在攻克实体瘤方面更具希望。此外,TIL疗法还具有临床副作用小、制备成本低等优势。
国内已有多家药企在此布局,包括沙砾生物、君赛生物、天科雅、厚无生物、西比曼生物、智瓴生物、劲风生物、原启生物、蓝马医疗、华赛伯曼、循生医学、卡替医疗等,并且有多款TIL产品获批开展临床。
例如,2022年2月,劲风生物宣布其TIL疗法临床I期申请获得FDA批准,成为国内首家TIL疗法获批临床的药企。
2022年4月,沙砾生物的TIL疗法GT101注射液IND申请获得NMPA批准,用于治疗转移或复发的实体瘤,成为国内首个获批临床的TIL疗法。同月,君赛生物自主研发的TIL疗法产品“自体天然肿瘤浸润淋巴细胞注射液(GC101 TIL)”获得临床批件,该产品是全球首个无需清淋、无需IL-2注射的天然TIL细胞治疗药物。
循生医学TIL细胞治疗药物临床试验的申请,则在2022年8月获得NMPA受理。随后的11月,NMPA又受理了智瓴生物ZLT-001注射液,以及天科雅的HV-101注射液的临床试验申请。
期待更多的TIL疗法取得进展,为患者带来治愈希望。






 个人中心
个人中心
 我是园区
我是园区





