
责编 | 兮
cGAS-STING天然免疫通路可以识别细胞质中异常出现的DNA(病原感染引入的外源DNA或宿主异常释放的内源DNA),并诱导I型干扰素和其他促炎因子的表达【1】。为了应对cGAS-STING通路强大的免疫压力,病原微生物也在与宿主的长期博弈过程中,进化出了多种策略来抑制该通路的活化【2】。但是,对于病原抑制cGAS-STING通路的具体机制,目前仍有大量未知亟待回答。
在cGAS-STING通路的信号转导过程中,除了经典的信号转导形式外(如分子间互作、催化修饰、以及第二信使的合成和扩散等),大分子的多聚和相分离也在其中发挥着至关重要的作用。近年来,国内外多家实验室在STING多聚化【3-6】和cGAS-DNA相分离【7-8】方面作出了多项漂亮工作,极大推进了我们对相分离调控天然免疫的理解。鉴于相分离对cGAS-STING通路活化的重要性,不难推测病原应该会进化出靶向该过程的反制措施。然而,目前还没有发现任何病原蛋白通过干预大分子相分离来抑制cGAS-STING通路。从更为广泛的角度来说,病原微生物对宿主细胞相分离的干预和调控,也鲜有研究报道。
2021年5月19日,中科院生物物理所高璞组/李栋组/邓红雨组合作在Molecular Cell杂志以研究长文形式在线发表题为 Viral tegument proteins restrict cGAS-DNA phase separation to mediate immune evasion 的文章。该工作发现α-和γ-疱疹病毒编码的一类进化遥远但结构相关的间质蛋白,可以通过新颖且保守的机制破坏cGAS-DNA相分离而实现免疫逃逸。

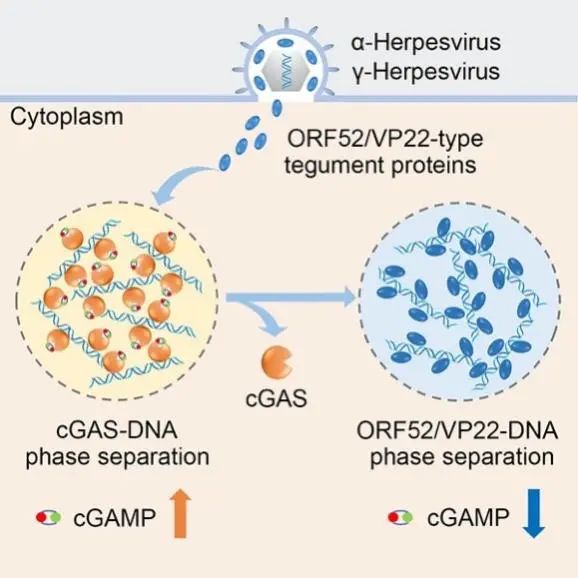
此前的研究报道,γ-疱疹病毒的间质蛋白ORF52【9】和α-疱疹病毒的间质蛋白VP22【10】可以直接作用于cGAS并抑制通路活化,但具体机制并不清楚。本项工作中,研究人员在体外测定了cGAS与多种ORF52/VP22类型间质蛋白的直接结合能力,意外发现它们之间并没有明显互作。另外,由于这类病毒蛋白的DNA亲和力比cGAS弱,而且它们并不抑制细胞质中其他的DNA免疫识别通路,这提示简单的DNA结合竞争也不能解释其功能。鉴于cGAS-DNA相分离在抗病毒反应中的重要性,以及ORF52/VP22的细胞质定位属性,研究人员推测这类病毒蛋白可能通过干预cGAS-DNA相分离来发挥其功能。
研究人员首先通过体外实验证明了ORF52/VP22可以有效破坏cGAS-DNA相分离。随后,在活细胞内利用新型光片显微镜进行小时量级三维高时空分辨成像,同样发现了这种相分离抑制效应。而且,病毒蛋白对cGAS-DNA相分离的抑制效应随其浓度升高和累积时间延长而提升。为了排除过表达的影响,研究人员还在cGAS本底表达水平的细胞中进行了验证,并观察到了类似现象。由于ORF52/VP22在病毒颗粒中高度冗余,研究人员推测病毒颗粒中携带的此类蛋白可能会在感染早期就作用于cGAS-DNA相分离,而后续的成像实验也验证了这种推测。因此,在体外、细胞内、以及病毒感染情况下,ORF52/VP22类型的间质蛋白都能够干预cGAS-DNA相分离。
有趣的是,在破坏cGAS-DNA相分离的过程中,病毒蛋白会逐步抽提cGAS-DNA液滴中的DNA,并与之形成自身的相分离聚集。研究人员进一步通过体外和细胞内的成像实验,确认了ORF52/VP22类型的病毒蛋白可以和DNA形成液-液相分离,而且这种相分离的形成能力显著强于cGAS-DNA。这也表明,蛋白被DNA诱导形成相分离的能力,与蛋白-DNA的亲和力之间并没有直接对应关系。
为了更清晰的了解其机制,研究人员对ORF52/VP22设计了多种突变,并进行了DNA结合、相分离观测、酶活分析、通路活性检测、及病毒感染等多种实验,结果表明:1)病毒蛋白与DNA的相分离聚集,依赖于蛋白-DNA之间的多价互作;2)病毒蛋白中的IDR区域(Intrinsically Disordered Regions),对其自身相分离及其对cGAS-DNA相分离的干预,都至关重要;3)病毒蛋白对cGAS-DNA相分离的抑制,取决于其被DNA诱导形成相分离的能力,而不是其与cGAS的直接互作,也不是其与DNA的亲和力强弱;4)如果病毒蛋白与DNA的相分离能力受到影响,那么其抑制cGAS-DNA相分离以及整个通路的能力也随之受到影响。
综上,此项工作发现了一类在进化距离上非常遥远、但结构上有一定相关性的疱疹病毒间质蛋白,可以通过新颖且保守的机制干预cGAS-DNA相分离,从而实现免疫逃逸。此项工作除了发现一种新颖的病原-宿主互作机制,也拓展了我们对大分子相分离调控复杂性的认识。
生物物理所高璞研究员、李栋研究员和邓红雨研究员为本文的共同通讯作者,博士生徐广军、刘冲和周胜为本文的共同第一作者。生物物理所博士生李权锦和孙盼盼在本工作中作出了重要贡献。中国科技大学的朱书教授也对本工作给予了帮助。
原文链接:
https://doi.org/10.1016/j.molcel.2021.05.002

李丕龙(清华大学)
如果说有哪种病毒曾经或正在困扰着几乎每一个地球人,如果你说是新冠病毒——对不起,那疱疹病毒肯定得偷着乐了。提起疱疹病毒,想必绝大多数人都不陌生。以I型人类单纯疱疹病毒(human herpesvirus 1,HSV-1 )为例,病发会导致皮肤、口腔、眼角膜、生殖器官等常见部位成群疱疹的感染,而致瘤性的卡波西肉瘤相关病毒(Kaposi’s sarcoma-associated herpesvirus,KSHV)则更是令人心惊胆战。因此,研究此类病毒具有极其重要的生物学和医学意义。疱疹病毒是一类含囊膜的双链DNA病毒,是迄今为止已知的最大病毒之一,其直径约为200 nm,包含四层结构,分别为表面囊膜(envelope)、间质 (tegument)、衣壳(capsid)以及DNA核心。其中,间质蛋白层是疱疹病毒特有的结构,位于病毒核衣壳和囊膜之间,已知在调控病毒的形态发生以及病毒包装与释放过程中发挥了非常重要的作用。病毒与宿主之间的博弈极为巧妙,病毒感染可以激活宿主细胞的抗病毒天然免疫,而其自身同时也进化出多种策略来逃逸宿主的抗病毒免疫并建立潜伏感染。已知疱疹病毒编码的VP24、UL46、US3、VP16、UL36、UL41、VP22、UL42、ICP0、UL24、US11等蛋白均可通过干扰宿主的抗病毒天然免疫信号通路,进而促进病毒增殖。
近日,Molecular Cell在线发表了来自中国科学院生物物理研究所高璞研究员、李栋研究员以及邓红雨研究员的研究论文,首次揭示了疱疹病毒间质蛋白通过抑制cGAS-DNA的相分离进而实现免疫逃逸的新功能。cGAS作为信号感受器,在病毒感染期间,能够识别双链DNA使得自身构象发生改变,从而促进AMP和GMP合成为cGAMP,而cGAMP能够被STING识别,从而激活下游信号通路。由此可知,cGAS的激活需要其直接结合双链DNA并形成类似于液滴状态的蛋白-核酸凝聚体,从而收集入侵的核酸分子并扩增信号传导。然而,道高一尺魔高一丈,高璞等课题组的研究发现,疱疹病毒的间质蛋白ORF52/VP22通过竞争性地结合DNA形成凝聚体,将cGAS激活所需要的分子(比如底物ATP和GTP)排挤在外,进而阻断cGAS-DNA凝聚体的形成。值得一提的是,间质蛋白与cGAS之间并无强烈的直接相互作用,相反,病毒蛋白利用与DNA形成多价相互作用和液液相分离的特性进而实现阻断。这一简单、聪明且新颖的策略在病毒进化史上也是高度保守的,并在α-/γ-属疱疹病毒中同时得到了验证。
该研究的发现无疑也拓宽了相分离参与调控免疫逃逸保守机制的新认识。从更广泛的范围看,真核细胞里有大量有时特别动态的无膜细胞器,它们直接存在复杂互动关系。高璞等的研究论文提供一个很好的例子,展示了病原体的凝聚体特异拮抗宿主天然免疫信号通路里的重要凝聚体。类似或其它关系的宿主-宿主凝聚体以及病原体-宿主凝聚体会继续被领域内科学家发现,让我们拭目以待。

傅天民(俄亥俄州立大学医学院)
病原与宿主间的军备竞赛:师夷长技以制夷
免疫系统也许是生物体(宿主)抵御周围环境中各类病原最基本的屏障,高等生物的免疫系统可以分为天然免疫和适应性免疫。其中,天然免疫是宿主抵御病原侵袭的第一道防线。宿主细胞能够表达多种类型的天然免疫受体,这些受体能够感知病原的特定分子,进而激活免疫信号通路,产生免疫应答,实现免疫防御。其中,cGAS是近年来发现的一类重要的天然免疫受体。cGAS分布在细胞的胞质内,能够识别双链DNA。当双链DNA和cGAS结合后,能够激活cGAS的酶活性,合成一个叫做cGAMP的小分子。cGAMP结合到一个叫做STING的蛋白上,引发STING的构象变化和高聚化,进而激活下游的免疫蛋白,最终引发免疫应答。因此,cGAS-STING免疫信号通路在感知病原侵染中发挥着不可或缺的作用,特别是对宿主抵御双链DNA病毒的侵袭意义重大。
自cGAS发现以来,cGAS的活化机制一直是领域内的重要科学问题。2013年,高璞博士在美国纪念斯隆凯萨琳研究所做博士后时,解析了cGAS和DNA的复合物晶体结构,阐明了DNA激活cGAS的分子机理,是该领域的重大科学突破。2018年,美国西南医学中心的陈志坚教授课题组报道了cGAS和DNA能够形成相分离,有效提高了cGAS的局部浓度,增强了cGAS的酶活性,阐释了相分离对cGAS活化的重要意义。今年年初,哈佛大学医学院的Kranzusch课题组进一步发现cGAS-DNA形成的相分离还能对双链DNA起到保护作用,增强免疫应答。随之而来的一个重要科学问题就是,病原有没有适当的策略来反击宿主的这一防御机制。
2021年5月19日,中国科学院生物物理所高璞、李栋、邓红雨课题组合作在Mol Cell杂志发表研究文章,报道了病毒间质蛋白通过相分离机制与cGAS竞争DNA,进而抑制cGAS催化活性,达到抑制宿主免疫应答的目的。这一研究不仅代表了cGAS-STING信号转导领域的重要科学进展,也是病原与宿主互作领域和相分离领域的重大进展。总结起来,这篇文章有三大亮点:第一、这是首次发现病原微生物可以调控宿主细胞内的相分离;第二、病毒蛋白对cGAS活性的抑制,不是通过病毒间质蛋白与宿主免疫受体cGAS直接相互作用,而是通过相分离的方式竞争DNA来实现的;第三、文中揭示了不同病毒的间质蛋白可以通过相同的机制来抑制宿主的免疫防御,这些病毒的间质蛋白虽然序列差异很大,但是都含有正电荷富集区和固有无序结构区,这些区域对于病毒蛋白与DNA形成相分离不可或缺。
笔者阅读此文时,一方面震撼于大自然的神奇奥妙,另一方面又为纷繁复杂的自然现象背后那简单统一的自然法则而惊叹不已:原来宿主和病原可以用一套简单的机制进行相互拮抗,上演着一场场没有硝烟的战争。
展望未来,在这项研究的基础上许多问题可以进一步探讨。例如,在宿主体内,有没有其他蛋白参与这场没有硝烟的战争?假如有的话,这些蛋白如何改变病原和宿主军备竞赛?宿主体内病毒间质蛋白形成的相分离如何实现时空调控?这些病毒蛋白形成的相分离有没有参与其他的生命活动。
参考文献
【1】Hopfner, K.P., and Hornung, V. (2020). Molecular mechanisms and cellular functions of cGAS-STING signalling. Nat. Rev. Mol. Cell Biol. 21, 501–521.
【2】Eaglesham, J.B., and Kranzusch, P.J. (2020). Conserved strategies for pathogen evasion of cGAS-STING immunity. Curr. Opin. Immunol. 66, 27–34.
【3】Shang, G., et al. (2019). Cryo-EM structures of STING reveal its mechanism of activation by cyclic GMP-AMP. Nature. 567, 389-393.
【4】Zhang, C., et al. (2019). Structural basis of STING binding with and phosphorylation by TBK1. Nature. 567, 394-398.
【5】Fang, R., et al. (2021). Golgi apparatus-synthesized sulfated glycosaminoglycans mediate polymerization and activation of the cGAMP sensor STING. Immunity. 5, 962-975.
【6】Yu, X., et al. (2021). The STING phase-separator suppresses innate immune signaling. Nat. Cell Biol. 23, 330-340.
【7】Du, M., and Chen, Z.J. (2018). DNA-induced liquid phase condensation of cGAS activates innate immune signaling. Science. 361, 704–709.
【8】Zhou, W., et al. (2021). cGAS phase separation inhibits TREX1-mediated DNA degradation and enhances cytosolic DNA sensing. Mol. Cell. 81, 739-755.
【9】Wu, J.J., et al. (2015). Inhibition of cGAS DNA Sensing by a Herpesvirus Virion Protein. Cell Host & Microbe. 18, 333–344.
【10】Huang, J., et al. (2018). Herpes Simplex Virus 1 Tegument Protein VP22 Abrogates cGAS/STING-Mediated Antiviral Innate Immunity. J. Virol. 92, e00841–18.
转载须知
【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经允许禁止转载,作者拥有所有法定权利,违者必究。




 个人中心
个人中心
 我是园区
我是园区




