您还不是认证园区!
赶快前去认证园区吧!
主要原因:
规格不合理,小于说明书推荐单次使用最小剂量
该品种已发布原研进口产品作为参比制剂,且企业申请的参比制剂与已发布的参比制剂浓度一致
本品与国内上市品种装量不同,与国内已批准用法用量存在差异,给药受限
本品无参比制剂地位
未提供完整和充分的安全性、有效性数据
-
有关物质存在一定缺陷
此前:
算上第三十五批,累计85个参比审议未通过。
2020年8月5日,CDE发布了第三十二批参比制剂征求意见稿,其中8个审议未通过
2020年7月30日,CDE发布了第三十一批参比制剂征求意见稿,其中20个审议未通过
2020年6月30日,CDE发布了第三十批参比制剂征求意见稿,其中9个审议未通过
2020年5月19日,CDE发布了第二十九批参比制剂征求意见稿,其中4个审议未通过
2020年1月10日,CDE发布了第二十六批参比制剂征求意见稿,其中22个审议未通过
2020年1月10日,CDE发布了第二十五批参比制剂征求意见稿,其中7个审议未通过
2020年9月7日,CDE发布了第三十三批参比制剂征求意见稿,其中5个未通过审议!
2020年9月7日,CDE发布了第三十四批参比制剂征求意见稿,其中1个未通过审议!


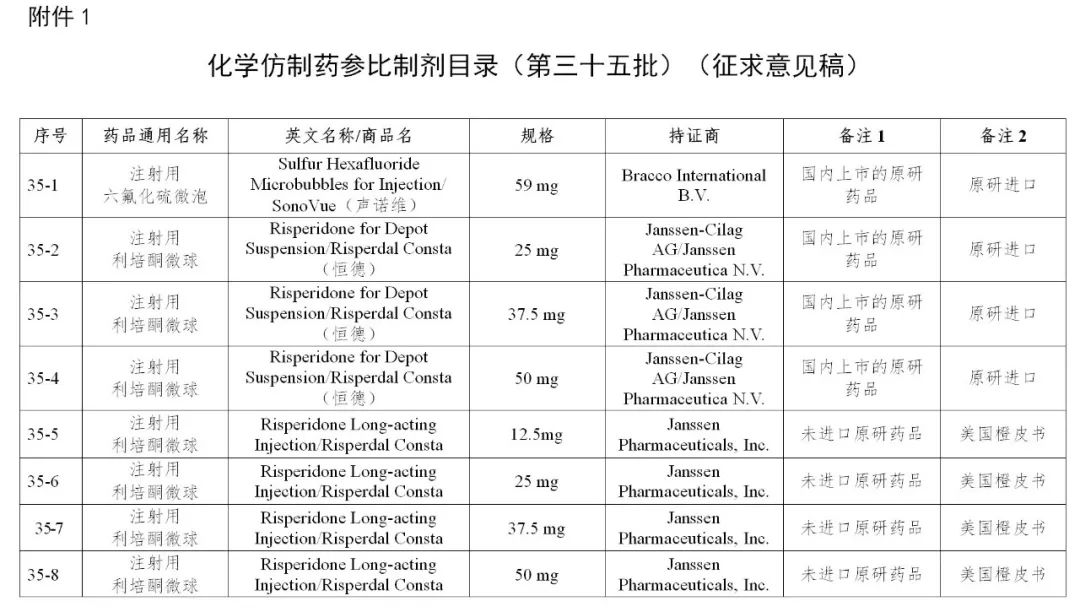
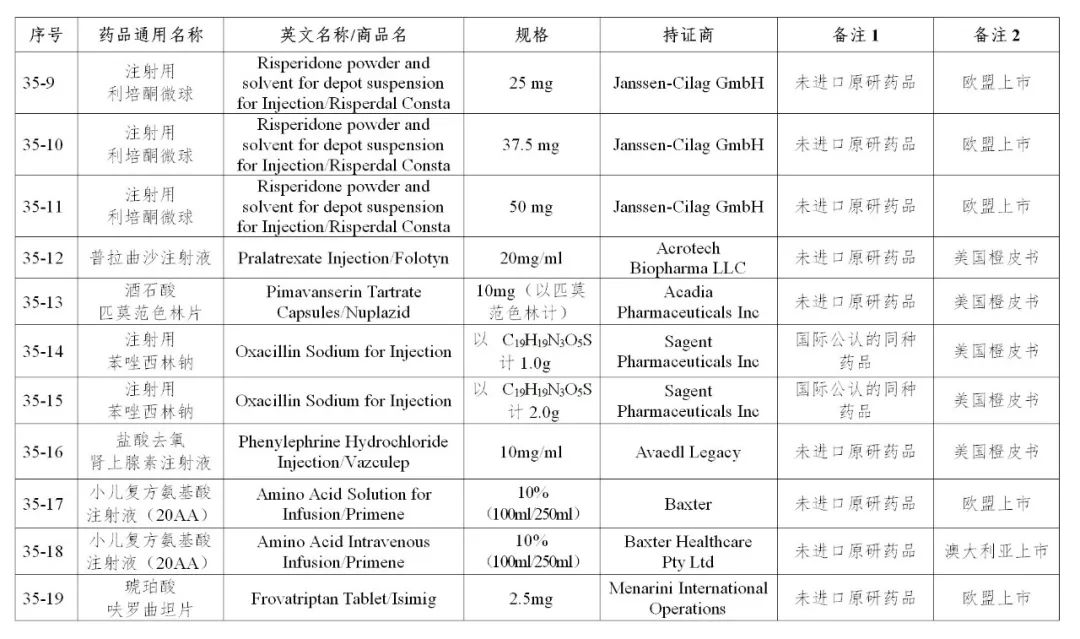
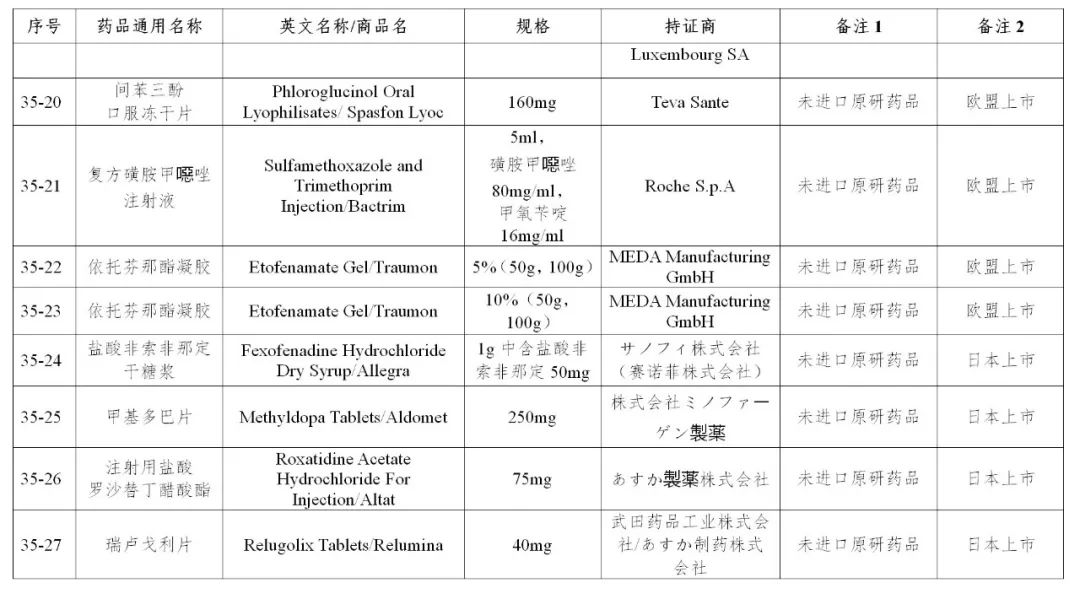

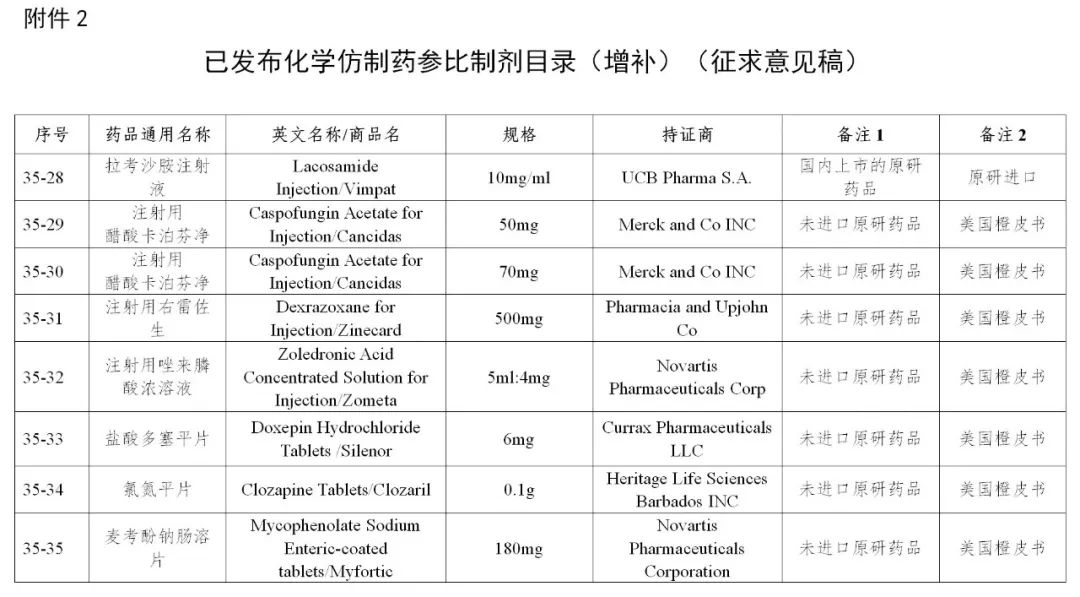
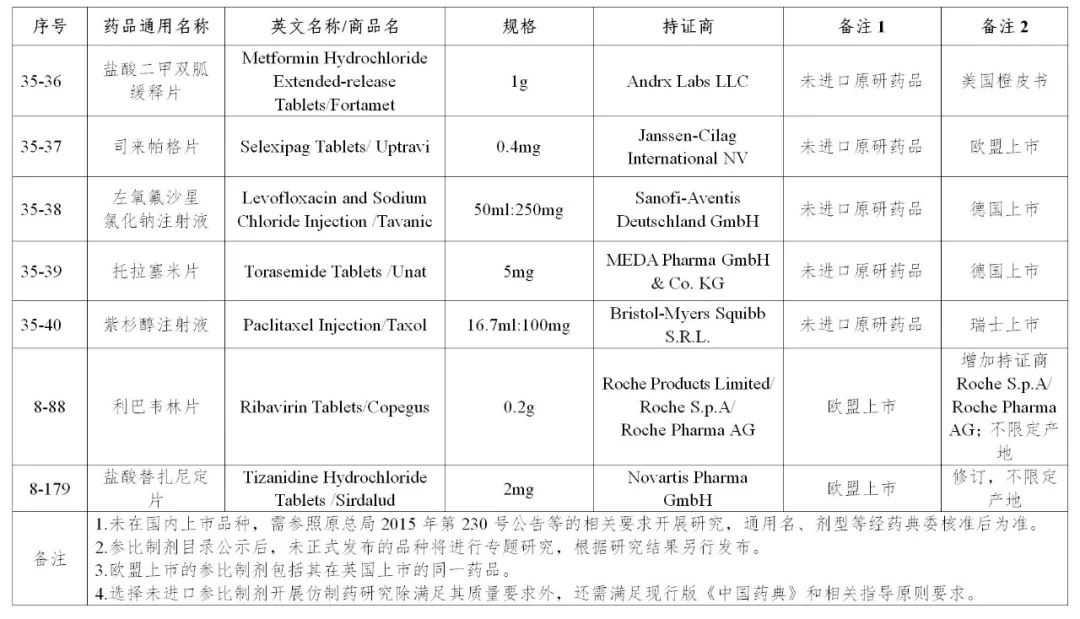
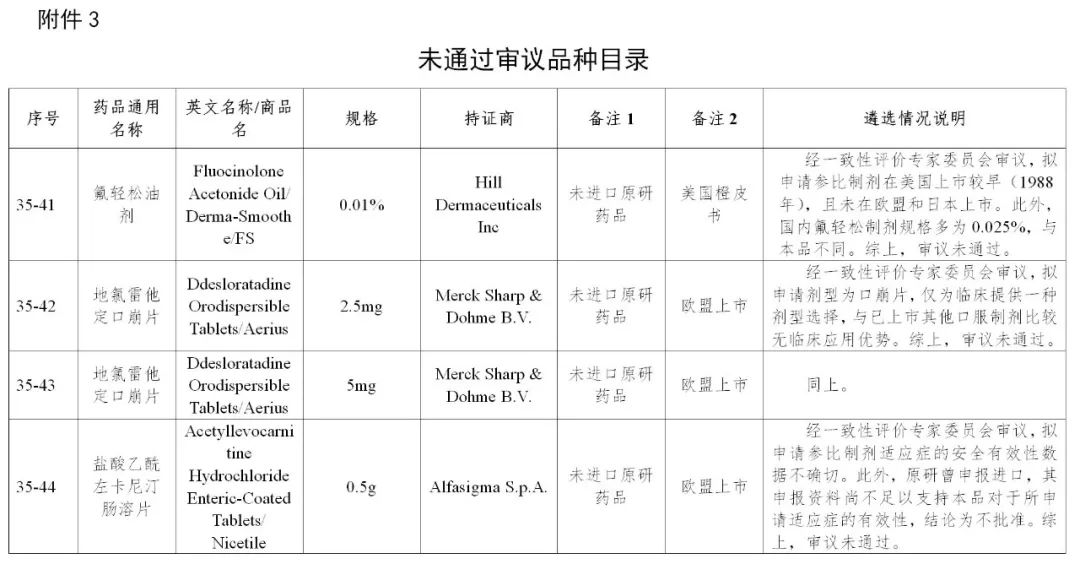
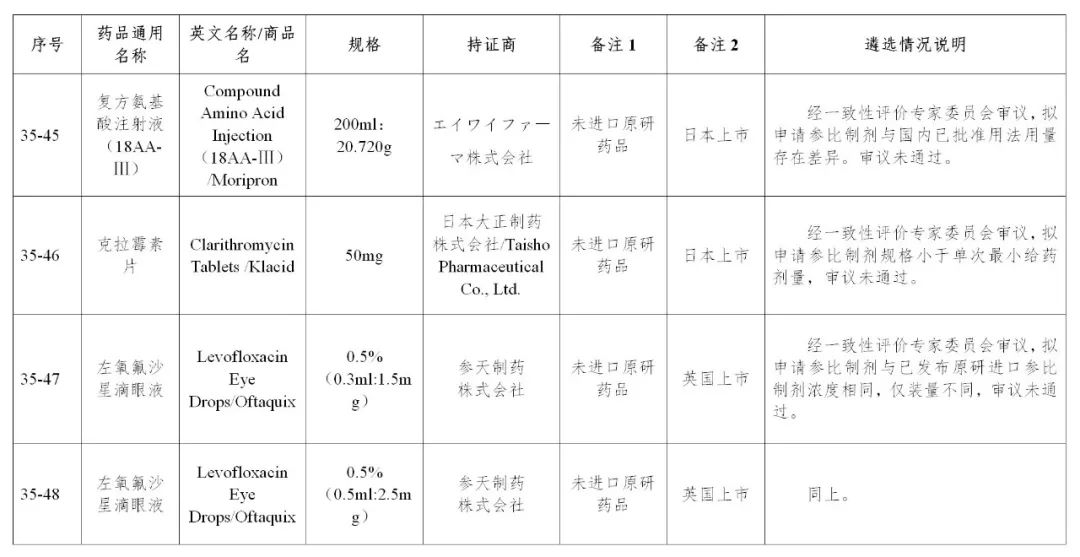
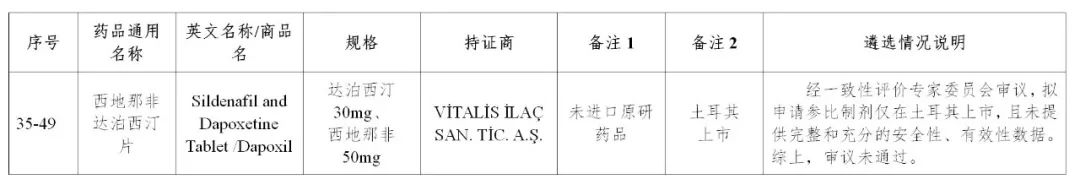
来源:CDE、药物一致性评价




 个人中心
个人中心
 我是园区
我是园区




