▎药明康德内容团队报道
5月12日,百时美施贵宝(BMS)与BridgeBio Pharma公司达成独家协议,以共同开发和商业化后者在研的SHP2抑制剂BBP-398,BridgeBio公司将获得超过9亿美元的前期付款和里程碑付款。这一研发合作再次引起了人们对SHP2抑制剂的关注。
值得注意的是,在过去几十年中,SHP2一直被认为是“不可成药”靶点。而近几年来,该靶点却吸引了越来越多的生物医药公司投入研发。公开资料显示,目前全球至少有10款SHP2抑制剂已经进入临床研究阶段。本文中,我们就来梳理SHP2如何从“不可成药”靶点成为“潜力靶点”,以及目前备受关注的部分在研SHP2抑制剂。
SHP2全称是含Src同源2结构域蛋白酪氨酸磷酸酶,由Ptpn11基因编码,结构包含N端的2个Src同源2结构域和C端的1个具有催化功能的PTP结构域。
研究表明,Ptpn11基因突变导致SHP2蛋白的持续激活在多种人类发育性疾病和癌症中都被发现,如白血病、努南综合征等。
SHP2也是诸多蛋白激酶通路上的重要调控蛋白,
通过RAS通路促进癌细胞存活和生长,在癌细胞对靶向治疗产生耐药性的方式中发挥关键作用。此外,SHP2可以通过结合PD-1、BTLA等抑制性的免疫检查点来调节T细胞的活化。
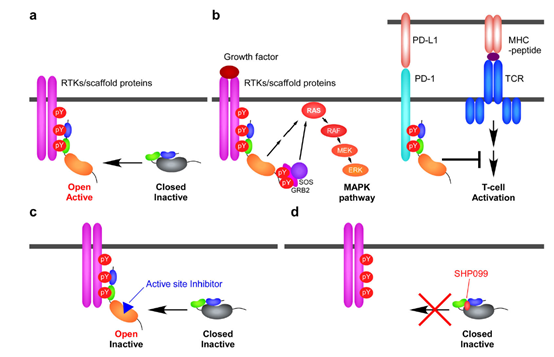
▲SHP2介导的信号通路以及SHP099作用机制(图片来源:参考资料[2])
提到SHP2,不得不提
蛋白激酶
和
蛋白磷酸酶
,这两大类蛋白在细胞中维系着对细胞生命活动非常重要的蛋白磷酸化调控的平衡。
其中,蛋白激酶很早就被作为药物靶点进行研究,但蛋白磷酸酶抑制剂却由于两大方面的问题无法进入临床应用:
第一是特异性问题
,这些抑制剂多作用于磷酸酶的催化域,同家族蛋白磷酸酶催化域高度保守,抑制剂难以区分不同亚型的磷酸酶,从而带来潜在的副作用;
第二是蛋白磷酸酶的催化域倾向于结合带负电的分子
,而带负电荷的小分子抑制剂存在细胞透膜性差、口服生物利用度低等问题。
直到近几年来,一系列作用于
蛋白磷酸酶催化域以外潜在位点
的小分子变构抑制剂逐渐被发现,使蛋白磷酸酶作为药物靶点重获希望,其中就包括了SHP2变构抑制剂。
与其它蛋白磷酸酶一样,早期针对SHP2的PTP结构域的抑制剂也存在选择性差、活性低、成药性差的缺点。
2016年,诺华
(Novartis
)在顶级学术期刊Nature上
报道了一款名为SHP099的化合物,该化合物能
结合到2个SH2结构域和PTP结构域三者之间(称为“隧道”位点)
而抑制SHP2活性。
这一独特的作用方式使SHP099成为首个高选择性的SHP2抑制剂。
SHP099的发现无疑为SHP2这一靶点的研究开启了希望之门。在之后的研究中,诺华进而对SHP099进行了改造,并开发了一系列活性更高、药物代谢性质更好的化合物,其中就包括了目前处于2期临床试验阶段的T
NO155。诺华曾在新闻稿中指出,TNO155是首款进入临床阶段的SHP2抑制剂。在早期试验中,它与Mirati T
herapeutics公司的KRAS抑制剂adagrasib(MRTX849)联用,在治疗携带KRAS G12C突变的癌症患者上彰显了潜力。
与此同时,更多研究机构和医药企业的科学家们也陆续发现了SHP2结构上更多变构位点,并陆续开发了多款靶向化合物。而多款SHP2抑制剂也都获得了全球性药企的青睐,
比如
开头获得BMS公司投资的BBP-398。
值得一提的是,
BridgeBio公司已经与联拓生物达成
合作
,在中国及其它主要亚洲市场进行BBP-398的临床开发和商业化,联拓生物目前正在中国进行该药的1b期临床组合疗法的研究。
再如,Revolution Medicines公司于2018年与赛诺菲(Sanofi)达成一项最高约5.5亿美元的合作,共同开发前者一款代号为RMC-4630的强效口服SHP2抑制剂。目前,RMC-4630也已进入2期临床开发阶段,针对适应症为KRAS突变的非小细胞肺癌。
加科思药业于2020年6月与艾伯维(AbbVie)达成全球战略合作,共同开发前者自主研发的
两款SHP2靶向小分子抑制剂,分别为JAB-3068和JAB-3312。据加科思药业公开资料介绍,它们可以同时与SHP2的三个结构域相互作用,将其锁定在封闭的非活性构象中,具备对SHP2的高效选择性。目前,
JAB-3068已经在中国和美国均进入1/2a
期
临床研究阶段,适应症为晚期实体瘤
。
Relay Therapeutics公司也于2020年12月与罗氏(Roche)旗下基因泰克(Genentech)达成
合作
,以开发和商业化前者的SHP2变构抑制剂RLY-1971,Relay公司因此获得超7亿美元的预付款和后续里程碑付款。作为一种SHP2强效小分子抑制剂,RLY-1971在临床前研究中表现出显著抗肿瘤活性,有潜力克服或延迟耐药性的发生。该药目前正在进行1期临床研究。

此外,还有一些中国公司开发的SHP2抑制剂在过去1年里接连进入临床开发阶段。包括:
奕拓医药基于蛋白质动态变化的技术平台开发的SHP2变构抑制剂
ET0038,
它可以结合SHP2蛋白构象变化带来的潜在药物变构位点
;
勤浩生物开发的SHP2抑制剂GH21对多种SHP2点突变体有效,对SHP2以外的磷酸酶、激酶以及安全性相关的靶点无显著影响,因此具有较好的安全性;诺诚健华的
ICP-189
是一种高选择性的口服SHP2变构抑制剂,对其它磷酸酶具有很好的选择性;
贝达药业的
BPI-442096
通过特异性靶向SHP2蛋白变构位点而抑制SHP2活化等等。
除了上述提到的药物,还有其它的SHP2抑制剂在进行临床前或临床研究,如辉瑞(Pfizer)公司的ARRY-558(PF-07284892)、Erasca公司的ERAS-601、圣和药业的SH3809等等,限于篇幅,本文不再一一列举。
SHP2靶向药物与其它药物的联合治疗潜力也备受期待。根据近期Cancer Discovery上发表的一篇综述,SHP2是间接抑制KRAS活性的主要靶点,与KRAS G12C抑制剂联用具有治疗广泛携带KRAS突变癌症患者的潜力。此外
,加科思药业董事长兼首席执行官
王印祥博士
早先在接受药明康德内容团队采访时谈到,与SHP2抑制剂联合用药也是学术界较公认的解决KRAS G12C抑制剂耐药的方案。
目前,探索SHP2抑制剂与KRAS G12C抑制剂的联合用药已经成为当下SHP2抑制剂开发的重要方向之一。早在2019年7月,诺华公司就与Mirati Therapeutics公司达成合作协议,探索将潜在“first-in-class”SHP2抑制剂TNO155与后者的KRAS G12C抑制剂adagrasib联用治疗携带KRAS G12C突变的晚期实体瘤的效果。此外,2021年10月,赛诺菲与Mirati公司达成
合作
协议,评估在研的SHP2抑制剂RMC-4630与adagrasib联用的疗效。另外,开头提到的BridgeBio公司的BBP-398与安进(Amgen)的首款靶向特定KRAS基因突变的抗癌疗法sotorasib(曾名为AMG 510)组合疗法、
加科思药业的SHP2抑制剂与自身研发管线中的KRAS G12C抑制剂组成的联合疗法都已进入临床开发阶段
。
除了与KRAS抑制剂联用,许多公司也在探索SHP2其它联合治疗方案的治疗效果
。2018年发表在Nature Reviews Drug Discovery的一篇综述总结道:几乎所有受体酪氨酸激酶(RTK)以激活SHP2为主要途径、甚至是唯一途径来激活RAS,因此SHP2抑制剂有可能将RTK基因突变一网打尽,成为治疗RTK改变或者RAS信号通路突变型癌症、PD-1/PD-L1无应答及难治性患者的联合疗法中的骨干药物。
比如,加科思药业正在临床试验中探索SHP2抑制剂
与PD-1抑制剂、MEK抑制剂等
联合用药的疗效。
再如,诺华公司的
TNO155正在探索与EGFR抑制剂(EGF816)、
ALK抑制剂(lorlatinib)
、ERK激酶抑制剂
(LTT462)
、CDK4/6抑制剂
(ribociclib)
等联用的效果。
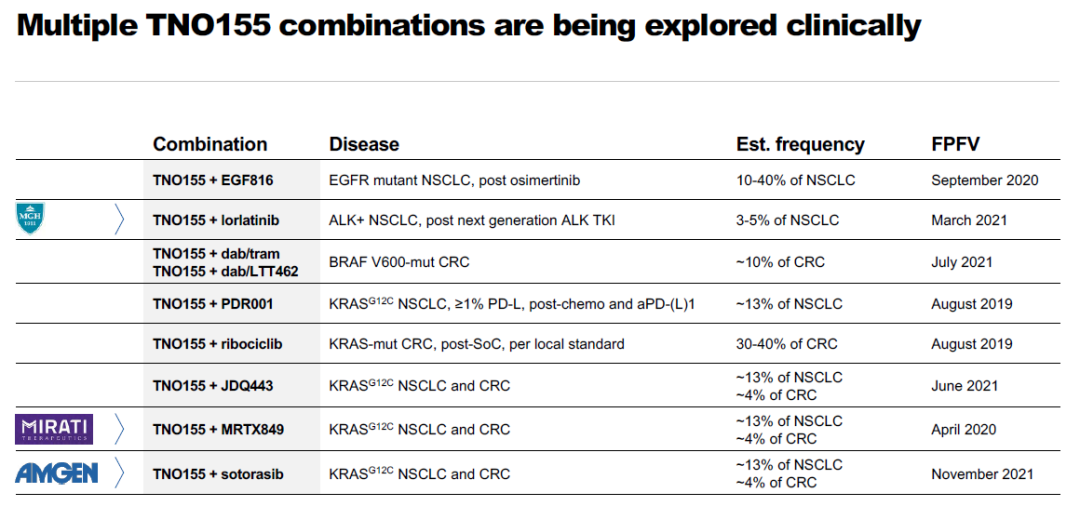
▲诺华于去年11月研发者日活动上公布
的TNO155联合疗法(截图来源:参考资料[8])
尽管业界在不断探索肿瘤免疫新靶点,并持续挖掘SHP2靶点药物的治疗潜力。但不能忽视的是,SHP2被定义为肿瘤致病基因的历史尚短,研究积累仍然有限。且相比于KARS靶点,SHP2的作用机制更为复杂,寻找生物标记物也会更加具有挑战。业内人士早前预期表示,针对SHP2靶点的药物开发还需要一段相对复杂的探索过程。我们期待,SHP2靶向药物研发能够尽快取得进一步的突破,早日造福患者。
[1] BridgeBio Announces Exclusive License Agreement with Bristol Myers Squibb to Develop and Commercialize BBP-398, a Potentially Best-in-Class SHP2 Inhibitor, in Oncology. Retrieved May 12 , 2022. from https://bridgebio.com/news/bridgebio-announces-exclusive-license-agreement-with-bristol-myers-squibb-to-develop-and-commercialize-bbp-398-a-potentially-best-in-class-shp2-inhibitor-in-oncology/
[2] H Ran,R Tsutsumi,T Araki,B Neel ,(2016).Sticking It to Cancer with Molecular Glue for SHP2. Cancer Cell. DOI:10.1016/j.ccell.2016.07.010
[3] 曹恒义,朱继东.(2020).蛋白酪氨酸变构抑制剂的研究进展.《药学进展》.DOI:1001-5094(2020)08-0588-13
[4] Ying-Nan P. Chen1, Matthew J. LaMarche et al.(2016)Allosteric inhibition of SHP2 phosphatase inhibits cancers driven by receptor tyrosine kinases. Nature. DOI: https://doi.org/10.1038/nature18621
[5]加科思招股书.Retrieved Dec 20 2020.from http://www.cninfo.com.cn/new/disclosure/detail?plate=hke&orgId=9900047696&stockCode=01167&announcementId=1208944008&announcementTime=2020-12-21%2008:40
[6]Mullard. (2018). Phosphatases start shedding their stigma of undruggability. Nature Reviews Drug Discovery. DOI:https://doi.org/10.1038/nrd.2018.201
[7]Revolution Medicines公司官网. From https://www.revmed.com/pipeline/rmc-4630
[8]Novartis R&D Day. Retrieved December 2, 2021, from https://www.novartis.com/sites/novartis_com/files/novartis-r-d-day-2021-presentation.pdf
本文来自药明康德内容团队,欢迎个人转发至朋友圈,谢绝媒体或机构未经授权以任何形式转载至其他平台。转载授权请在「医药观澜」微信公众号留言联系我们。其他合作需求,请联系wuxi_media@wuxiapptec.com。
免责声明:药明康德内容团队专注介绍全球生物医药健康研究进展。本文仅作信息交流之目的,文中观点不代表药明康德立场,亦不代表药明康德支持或反对文中观点。本文也不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。








 个人中心
个人中心
 我是园区
我是园区




