 点击关注↑药研技术汇
点击关注↑药研技术汇
欢迎点赞和转发哦~
《课程推荐》
《请点击蓝色链接阅读全文》
来源:四川药监局 编辑:wangxinglai2004
2022年08月12日,四川药监局发布了1则行政处罚通知,成都芝芝药业有限公司及该司生产负责人李贵权因严重违反《药品生产质量管理规范》分别受到处罚,其中生产负责人被处以10禁业及罚金。
成都芝芝药业有限公司、李贵权严重违反GMP案
行政相对人名称:
成都芝芝药业有限公司、李贵权
违法行为类型:
成都芝芝药业有限公司、李贵权严重违反《药品生产质量管理规范》
违法事实:
当事人2020年3月至2021年7月期间生产维儿康洗液和维妇康洗液过程中,生产过程控制、质量控制的记录和数据不真实;
成都芝芝药业有限公司生产负责人李贵权在生产上述产品期间未按照工艺规程生产,未严格执行相关生产操作规程。
2020年3月至2021年7月期间李贵权从成都芝芝药业有限公司所获收入195823元。
处罚依据:
依据《药品管理法》第一百二十六条、《药品生产监督管理办法》第六十九条第四项规定。
处罚内容:
对芝芝公司处50万元罚款; 责令芝芝公司停产1个月; 没收李贵权违法行为发生期间自本公司所获收入195823元,并处所获收入22%的罚款43081元; 禁止李贵权10年内从事药品生产经营活动。 以上罚没款合计738904元(大写:柒拾叁万捌仟玖佰零肆元整) 。
往期信息
上海东海制药股份有限公司涉嫌生产劣药案
行政相对人名称: 上海东海制药股份有限公司 案件名称:生产销售不符合国家标准的药品 违法事实: 2021 年 9 月 10 日,本局在上海市杨浦区共青路 486 号对当事人生产的九维鱼肝油(批号:201001;规格:复方;包装规 格:500 克/瓶)进行抽样,经上海市食品药品检验研究院检验,该批药品【性状】项和【含量测定】项下维生素A含量均不符 合规定(检验依据:国家药品监督管理局国家药品标准(试行)(地标升国标)第十三册 WS-10001-(HD-1201)-2002)。
2021年12月14日,本局向当事人送达了检验报告书。
2021 年12月23日,上海市食品药品检验研究院受理了当事人的复验申请。
2022 年1月19日,本局收到上海市食品药品检验研究院出具的复验检验报告书,该批九维鱼肝油【性状】项和【含量测定】项下维生素 A 含量的复验结果仍均不符合规定。
经查,2020年10月28日至12月30日,当事人生产九维鱼肝油(批号:201001;规格:复方;包装规格:500 克/瓶)8010 瓶。
2021年1月4日至 8月2日,当事人销售7920瓶。
本局抽样16瓶,当事人取样10 瓶,领用64 瓶用于产品推广展示(后退回 34 瓶),召回 11 瓶。
之后当事人从退回及召回的产品中又取样 3 瓶。现实际库存42瓶。当事人实际销售该批九维鱼肝油 7909 瓶。该批九维鱼肝油货值金额为人民币 86730元,当事人的违法所得为人民币 76645.14元。
处罚: 《中华人民共和国药品管理法》第一百一十七条第一款,《中华人民共和国药品管理法》第一百一十八条, 1、罚款(1500000元) 2、没收违法所得(76645.14元)
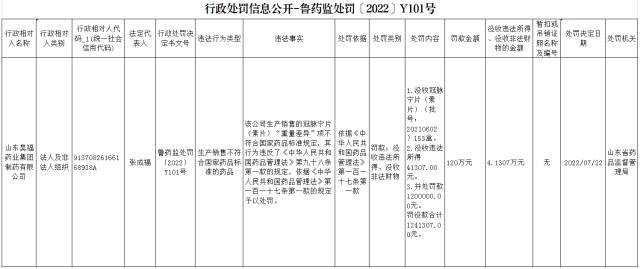
山东昊福药业集团制药有限公司
行政相对人名称: 山东昊福药业集团制药有限公司 案件名称:山东昊福药业集团制药有限公司生产销售不符合国家标准的药品 违法事实: 该公司生产销售的冠脉宁片 (素片)“重量差异”项不 符合国家药品标准规定,其行为违反了《中华人民共和 国药品管理法》第九十八条 第一款的规定,依据《中华人民共和国药品管理法》第一百一十七条第一款的规定予以处罚。
处罚: 依据《药品管理法》第一百一十七条予以处罚: 1、没收冠脉宁片153盒; 2、没收违法所得41307.00元; 3、并处罚款1200000元; 罚没合计1241307.00元
武汉贝参药业股份有限公司 
行政相对人名称: 武汉贝参药业股份有限公司 案件名称: 武汉贝参药业股份有限公司生产销售不合格板蓝根颗粒案 收到日期: 2022年 4月 21日
生效日期:2022年 5月 31日
作出主体:湖北省药品监督管理局违法事实: 武汉贝参药业股份有限公司 生产的板蓝根颗粒 (规格:每袋装10克,批号:20210312),经湖北省药品监督检验研究院检验, 【含量测定】项不符合标准规定。 湖北省药品监督管理局认为,武汉贝参药业股份有限公司生产销售的板蓝根颗粒(产品批号 20210312)含量测定项不符合药品标准规定,依据《药品管理法》(2019 年修订)第九十八条第三款第一项“药品成份的含量不符合国家药品标准”规定。 处罚: 湖北省药品监督管理局依据《药品管理法》(2019年修订)第一百一十七条规定,本着过罚相当、处罚与教育相结合的原则,责令武汉贝参药业股份有限公司改正上述违法行为,并决定处罚如下: 1.没收公司召回的板蓝根颗粒3919包和留样的7包,共计3926包; 2.处以公司违法生产销售的板蓝根颗粒货值金额3倍罚款,即人民币叁拾万元。 
企业应对措施或整改情况
公司积极配合调查,主动提供产品生产记录、检验记录以及有关票据等资料。在收到复检不合格报告后,立即分析排查问题发生原因,并采取召回措施,没有流入市场,主动减轻违法行为危害后果或者风险隐患。
辽宁美滋林药业有限公司 
2022年7月,我局对辽宁美滋林药业有限公司开展了药品GMP符合性检查,发现该企业药品生产存在不符合《药品生产质量管理规范(2010年修订)》要求的行为。 为有效控制药品安全风险,根据《中华人民共和国药品管理法》第九十九条第三款、《药品生产监督管理办法》第五十九条第一款第二项的规定,我局决定暂停辽宁美滋林药业有限公司的药品生产。 特此通告。 
贵州健瑞安药业有限公司 
行政相对人名称:贵州健瑞安药业有限公司 违法事实: 贵州健瑞安药业有限公司未遵守药品生产质量管理规范 处罚依据: 《行政处罚法》第二十八条第一款、第三十三条第一款,《药品管理法》第一百二十六条 处罚结果: 1.罚款; 2.没收违法所得;
3.责令停产停业。
黑龙江祥泰中药饮片有限公司生产、销售劣中药饮片“海风藤”(批号:160301)案 
行政相对人名称:黑龙江祥泰中药饮片有限公司 违法事实: 生产、销售劣中药饮片 处罚依据: 依据:《中华人民共和国药品管理法》第一百一十七条第二款、《中华人民共和国行政处罚法》第二十八条第二款、第三十七条。 处罚结果: 1.没收违法所得。 2.警告。 
飞检发现严重缺陷2项 
安徽佰顺堂中药饮片有限公司: 2022年6月21日至22日,我局在对你单位进行飞行检查中,发现严重缺陷2项、一般缺陷3项,质量管理体系不能有效运行。 根据《中华人民共和国药品管理法》第九十九条第三款规定,现通知你单位收到本通知后立即暂停生产如下产品: 1.中药饮片(净制、切制、蒸制、炒制、炙制、煅制)。 如对本通知书不服,可以自收到之日起60日内向安徽省人民政府或者安徽省药品监督管理局申请行政复议; 也可以在6个月内依法向亳州市谯城区人民法院提起行政诉讼。
飞检质量体系不能有效运行 
安徽家和中药科技股份有限公司: 2022年6月27-29日,我局对你单位飞行检查中,发现你单位的药品质量管理体系不能有效运行,中药饮片质量安全存在风险隐患。 根据《中华人民共和国药品管理法》第九十九条第三款、《药品生产监督管理办法》第五十九条规定,现通知你单位收到本通知后立即暂停中药饮片生产。 对检查中发现的相关违法违规线索,由省局第二分局依法立案查处。 如对本通知书不服,可以自收到之日起60日内向安徽省人民政府或者国家药品监督管理局申请行政复议;也可以在6个月内依法向合肥铁路运输法院提起行政诉讼。
编造批生产记录、批检验记录 行政相对人名称:四川鼎灏缘药业有限责任公司 行政处罚决定书文号:川药监罚决〔2022〕1002号 违法行为类型:编造批生产记录、批检验记录 违法事实:当事人编造批生产记录、批检验记录生产中药饮片黄芩片、中药饮片酒黄芩的行为,违反了《药品管理法》第四十四条第一款的规定 处罚依据: 依据《药品管理法》第一百二十四条第一款第六项、《四川省药品医疗器械化妆品行政处罚裁量权适用规则》第十三条第一项的规定 处罚内容: 一、没收违法所得15627.5元,违法产品黄芩片(批号:211201)1129.5公斤,酒黄芩(批号:211201)480公斤; 二、责令停产1个月;三、处货值金额76760元(不足10万按10万计算)5倍的罚款50万元。 以上罚没款共计515627.5元。 2022年4月6日(2022年4月6日送达) 
生产、销售中药饮片五加皮劣药 
行政相对人名称:亳州市圣海中药饮片有限公司 违法行为类型:生产、销售中药饮片五加皮劣药 违法事实: 2021年12月14日,接安徽省药品监督管理局转办《关于对不合格药品检验报告的函》(药监综便函﹝2021﹞527号),白城市食品药品检验所出具的不合格报告书(报告书编号:cy20210639) 检品名称:五加皮(批号:200101) 生产单位:亳州市圣海中药饮片有限公司 检验结果:【检查】总灰分(标准规定:应不得过11.5%,检验结果:12.8%)【浸出物】(标准规定:应不得少于10.5%,检验结果:8.0%)项不符合规定 处罚依据: 依据《中华人民共和国药品管理法》(2019修正本)第九十八条第一款、第三款第七项的规定,《中华人民共和国药品管理法》(2019修订本)第一百一十七条第一款的规定。 处罚内容: 1.没收违法所得肆万叁仟陆佰元(43600.00元); 2.处违法生产、销售药品货值金额(货值金额45100.00元)2.5倍的罚款(违法生产、销售的药品货值金额不足十万元的,按十万元计算),计拾贰拾伍万元整(250000.00元); 罚没款共计贰拾玖万叁仟陆佰元(293600.00元); 3.没收该批召回五加皮(批号:200101)30kg。
生产、销售劣药抗病毒口服液案 行政相对人名称: 上海六合堂生物科技项城制药有限公司 违法事实: 上海六合堂生物科技项城制药有限公司生产的抗病毒口服液,销售金额91053.3元,该企业发现该批药品不符合规定后,于2021年11月2日启动药品召回程序,共计召回批号201211的抗病毒口服液6869盒(68690支),退款金额26813.70元,违法所得64239.6元。 依据《中华人民共和国药品管理法》第九十八条第三款第(七)项“其他不符合药品标准的药品”的规定,为劣药; 其生产、销售行为,违反了《中华人民共和国药品管理法》第九十八条第一款“禁止生产(包括配制,下同)、销售、使用假药、劣药”的规定。 处罚依据: 依据《中华人民共和国药品管理法》第一百一十七条第一款 处罚结果: 没收违法所得64239.6元,处违法生产、销售药品货值金额十一倍的罚款,罚没款合计:1164239.6元 处罚时间:2022-06-14

生产、销售劣药珍宝丸案 行政相对人名称: 阜新蒙药有限责任公司 违法事实: 当事人生产劣药“珍宝丸”(批号:20210430),货值金额102,450元、违法所得18,015.00元 处罚依据: 依据《中华人民共和国药品管理法》第一百一十七条第一款。 处罚结果: 没收违法生产的药品和违法所得;罚款: 1.没收违法生产的劣药“珍宝丸”11255盒: 2.没收违法所得18,015.00元; 3.罚款1,331,850.00元。 
未遵守GMP、变更未按要求备案/报告 
行政相对人名称: 江西金世康药业有限公司
违法事实: 该公司存在未履行药品生产质量管理规范及未按照规定对药品生产过程中的变更进行备案或者报告行为 处罚依据: 违反了《中华人民共和国药品管理法》第四十三条第一款和第七十九条第一款的规定,依据《中华人民共和国药品管理法》第一百二十六条、第一百二十七条进行处罚; 处罚结果: 1、罚款
2、警告 
生产销售劣药 
行政相对人名称: 哈尔滨宇泰药业有限公司 违法事实: 哈尔滨宇泰药业有限公司生产的中药饮片绵马贯众(批号20180501)经抽检,浸出物项目不符合规定,属于生产销售劣药行为; 处罚依据: 依据:《中华人民共和国药品管理法》(2015年修正)第七十四条,第七十八条。 处罚结果: 1.没收违法生产的饮片。 2.没收销售劣药的违法所得。 3.处以生产劣药货值金额2倍罚款。 
质量体系不能有效运行、暂停生产 
安徽庆春堂药业有限公司: 2022年6月29-7月1日,我局对你单位飞行检查中,发现你单位的药品质量管理体系不能有效运行,中药饮片质量安全存在风险隐患。 根据《中华人民共和国药品管理法》第九十九条第三款、《药品生产监督管理办法》第五十九条规定,现通知你单位收到本通知后立即暂停中药饮片生产。

对检查中发现的相关违法违规线索,由省局第二分局依法立案查处。 如对本通知书不服,可以自收到之日起60日内向安徽省人民政府或者国家药品监督管理局申请行政复议; 也可以在6个月内依法向合肥铁路运输法院提起行政诉讼。
免责声明:文章版权归原作者所有。如涉及作品内容、版权和其它问题,请跟我们联系删除!文章内容为作者个人观点,并不代表本公众号赞同或支持其观点。本公众号拥有对此声明的最终解释权。
2022制药企业培训通知:
地点 时间 点击↓课题链接阅读全文 南京
线上8月19-21日 药品冻干工艺流程设计、优化、技术转移、验证及制剂处方研究高级研修班 线
上8月23-24日 研发质量体系构建-研发QA与生产QA的区别 线
上8月24-25日 cGMP厂房新建要点剖析和项目管理实战经验分享 烟
台8月24-26日 第六届生物活性肽健康产业论坛暨首届千滋百[肽]优肽盛典通知 南京
线上8月26-28日 化工制药企业工业节能提效技术与应用实战案例 南京
线上8月26-28日 医药化工中试放大工艺优化、难点解析及放大安全评估 线
上8月27-28日 生物制品中美申报策略及资料撰写要点案例分析 线
上8月27-28日 mRNA疫苗质量分析和方法开发及表征研究 线
上8月27-28日 细胞治疗产品质量体系建立与GMP实施 线
上8月27-28日 ADC抗体偶联药物研发策略及质量控制 线
上8月27-28日 细胞株开发及培养工艺放大 线
上8月29-31日 药品注册生产现场与GMP二合一全流程模拟检查 南京
线上9月2-4日 细胞基因药物厂房设计及生命周期管理 上海
线上9月3-4日 创新型mRNA疫苗研发中质量控制要点分析及非临床安评策略 南京
线上9月15-17日 制药和化工企业电气防爆全生命周期管理与选型安装、检查维护实操 南京
线上9月16-18日 蛋白及多肽药物工艺开发及申报策略 南
京9月16-18日 基于化学创新药案例的药物分析人员关键岗位技能提升 线
上9月16-17日 生物制品CDMO委托全流程及转化放大 杭
州9月16-18日 中美欧药品审评沟通交流会全流程及案例分析 线
上9月17-18日 细胞治疗产品的质量研究和方法验证及工艺验证 线
上9月17-18日 新规下的CSV SME计算机化系统全实例分析 线
上9月18日 从ADC的技术发展看设计要点 南
京9月23-25日 蛋白和多肽类药品注册申报(从IND到BLA)案例分析 线
上9月24-25日 微生物表达纯化工艺设计及开发策略 线
上9月24-25日 细胞分离纯化工艺开发及优化 线
上9月24-25日 实验室质量控制系统的整体要求
【提供制药企业及相关单位内训服务】
添加微信15910678046免费获取专业书籍,
课件PPT,有机会获取免费名额参会!
请注明:公司+姓名+职位+电话

关注药研技术汇每天都有药届新闻和课件与大家一起分享!



 个人中心
个人中心
 我是园区
我是园区









