转载(肿瘤医学论坛)
转载仅作观点分享,版权归最初的原作者所有
如有侵犯版权,请及时联系小编
摘要
肺癌是癌症相关死亡的主要原因之一,其中非小细胞肺癌(non-small cell lung cancer,NSCLC)约占肺癌全部病例数的80%~85%。大部分NSCLC患者初诊时即为晚期,尽管传统化疗、免疫治疗等取得了显著的进展,其总体预后仍然较差。近年来,随着精准医学的不断进步,新兴靶点及相应药物研究越来越多,使靶向治疗的前景日趋广阔。目前,NTRK基因融合已被证实与多种实体瘤的发生发展密切相关,其在NSCLC中的发生率约为0.2%,且通常不与其它常见致癌驱动基因重叠。研究显示,原肌球蛋白受体激酶(tropomyosin receptor kinase,TRK)抑制剂在NTRK基因融合阳性的实体瘤中表现出了良好的疗效和安全性,难治性NSCLC患者可从中明显获益。本文就NTRK基因融合和TRK抑制剂在NSCLC中的研究进展进行综述。
前言
肺癌目前仍居癌症死亡病因之首[1], 非小细胞肺癌(non-small cell lung cancer, NSCLC)是最常见的病理类型, 占全部病例数的80%~85%。57%的NSCLC患者初诊时即存在远处转移, 5年生存率仅为5%[2]。随着分子生物学及检测技术的快速发展, 驱动基因的研究及相应的靶向药物的研发为晚期NSCLC治疗带来了革命性的变化。NTRK基因融合已被证实是多种实体瘤的驱动基因, 如结直肠癌、甲状腺癌、婴儿型纤维肉瘤和NSCLC等[3-6]。研究显示原肌球蛋白受体激酶(tropomyosin receptor kinase, TRK)抑制剂在NTRK基因融合的实体瘤中具有良好的疗效和安全性, 为晚期NSCLC患者带来新的希望。
01
NTRK基因融合
NTRK基因家族包含NTRK1、NTRK2和NTRK3, 分别负责编码TRK家族蛋白TRKA、TRKB和TRKC[7-9]。TRK家族蛋白由位于细胞外的配体结合区、跨膜区和位于细胞内的酪氨酸激酶区组成。不同的神经营养因子对特定的TRK受体具有高度亲和性, 其中神经生长因子(nerve growth factor, NGF)选择性结合TRKA, 脑源性生长因子(brain-derived growth factor, BDGF)及神经营养因子-4(neurotrophin-4, NT4)选择性结合TRKB, 神经营养因子-3(neuro-trophin-3, NT3)与3种受体均可结合, 但与TRKC亲和力最高[10]。当TRK受体蛋白与相应配体结合, 可通过激活下游信号途径如Ras/MAPK通路、PI3K通路、PLC-γ通路等实现不同生理功能[11]。TRK家族蛋白正常情况下主要表达于神经组织, 参与神经细胞的分化和存活, 以及轴突和树突的形成, 在胚胎发育和神经系统正常功能的维持中起着重要的作用[12]。
当NTRK基因与其它基因发生融合, 异常的TRK融合蛋白可不依赖于配体, 持续激活下游多条信号途径, 促进肿瘤细胞的增殖和转移。1986年MartinZanca等[3]在结直肠癌中首次报道NTRK融合基因TPM3-NTRK1。随着研究的深入, 已发现30余种NTRK基因融合类型, 如ETV6-NTRK3、NFASCNTRK1、BCAN-NTRK1等[5, 13]。NTRK基因融合存在于多种实体瘤中, 其发生率因肿瘤类型而异, 在NSCLC、乳腺癌等常见肿瘤中不足1%, 而在分泌性乳腺癌、婴儿型纤维肉瘤等罕见肿瘤中则大于90%[14]。
02
NTRK基因融合与NSCLC
随着对NSCLC发生发展机制的深入研究, 越来越多的新兴靶点被发现。近年来, 除表皮生长因子受体(epidermal growth factor receptor, EGFR)、间变性淋巴瘤激酶(anaplastic lymphoma kinase, ALK)、c-ros原癌基因1酪氨酸激酶(c-ros oncogene 1, receptor tyrosine kinase, ROS1)等常见靶点外, 一些罕见的驱动基因逐渐被重视, 其中NTRK基因融合阳性即为NSCLC的一个独特分子亚型。
NTRK基因融合通常不与其它常见致癌驱动基因同时存在, 虽然其在所有NSCLC中的发生率仅为0.2%, 但在无常见已知突变的NSCLC中发生率可增至3%。针对NTRK基因融合的靶向治疗药物, 为无法使用常规靶向治疗药物的患者提供了新的选择。目前尚未发现NTRK基因融合与特定性别、年龄及吸烟状况等显著相关, 其临床病理特征仍需更大规模的研究来证实。
2013年, Vaishnavi等[6]共检测了91例无其它常见突变的肺腺癌病例, 发现3例存在NTRK基因融合(3.3%), 融合类型分别为MPRIP-NTRK1、CD74-NTRK1和TMP53-NTRK2。随后, Farago等[15]在4 872例NSCLC患者的数据中收集到11例NTRK基因融合阳性病例(0.2%), 均无其它常见已知突变, 回顾性研究显示NTRK基因融合可发生于任何性别、年龄及吸烟状况的患者。而Tatematsu等[16]在268例手术切除的NSCLC标本中并未发现NTRK基因融合。在肺大细胞神经内分泌癌中, NTRK基因融合的发生率明显高于其它类型NSCLC。在一项纳入538例肺癌病例的研究中, 肺大细胞神经内分泌癌中NTRK基因融合的发生率高达31.0%[17]。并且, 有研究发现BDNF/TRKB通路参与肺大细胞神经内分泌癌的形成及侵袭, 为其治疗的探索提供了新的方向[18]。
TRKB高表达促进了肺癌细胞的生长和转移, 并与NSCLC患者的不良预后密切相关, 提示其是一种潜在的抗肿瘤靶点。体外研究证实, 在人肺癌细胞株中下调TRKB表达可显著降低肺癌细胞的转移能力[19]。同时, 对肺鳞癌标本进行检测发现, TRKB高表达的患者更易发生血管侵袭及淋巴结转移, 疾病往往处于更晚的分期[20]。一项纳入102例NSCLC患者的回顾性研究, 通过免疫组织化学法(immunohisto-chemistry, IHC)检测TRKB的表达情况, 结果显示TRKB阳性组的无病生存期和总生存期明显短于TRKB阴性组[21]。另外, 有研究发现NTRK基因融合可能是EGFR-酪氨酸激酶抑制剂(EGFR-tyrosine ki-nase inhibitors, EGFR-TKIs)的耐药机制之一。Xia等[22]在21 155例中国肺癌患者中检测到12例NTRK1基因融合病例, 其中6例同时存在EGFR突变并且曾接受过EGFR-TKIs治疗。(表 1)
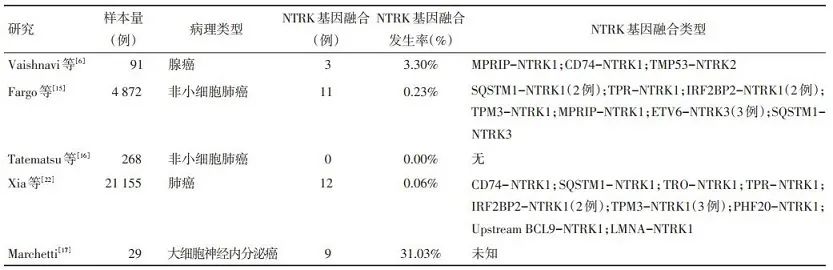
表 1 NTRK基因融合在非小细胞肺癌中的研究汇总
03
NTRK基因融合的检测
2019年第3版美国国家综合癌症网络(NCCN) NSCLC指南新增NTRK基因融合为肺癌靶向用药相关基因检测, 如何成功地筛选出NTRK基因融合的NSCLC患者是治疗成功的前提[23]。在选择NTRK基因融合检测方式时, 需考虑时间、技术、成本等多种因素。目前可选择的方法有IHC、荧光原位杂交法(fluorescence in situ hybridization, FISH)、逆转录聚合酶链式反应(reverse transcription-polymerase, RT-PCR)和第二代测序技术(next-generation sequencing, NGS)。
欧洲肿瘤内科学会(ESMO)指南[24]提出了"两步方案"的检测方法。在NTRK基因融合发生率低的肿瘤类别中, pan-TRK IHC被认为是快捷可靠的筛选方法。当前期检测显示TRK蛋白表达阳性的情况下, 推荐用NGS证实是否存在特定的基因改变。Hsiao等[25]将肿瘤类别按NTRK基因融合发生率和TRK蛋白表达率情况分为三类, NSCLC被归类于低NTRK基因融合发生率和低TRK蛋白表达组。对于未常规行分子检测的患者, 推荐先行pan-TRK IHC进行评估。对于已行分子检测且常见靶点如EGFR、ALK、ROS1等均为阴性的患者, 首先推荐包含NTRK基因融合的NGS。当怀疑存在特定的NTRK基因融合类型时, 可考虑选择FISH或RT-PCR检测[26]。
04
TRK抑制剂在NSCLC的应用
近年来, 一系列TRK抑制剂已被证实对多种实体瘤的发生发展有明显的抑制作用。其主要分为两大类, 广谱TRK抑制剂和特异性TRK抑制剂, 前者可作用于包含TRK在内的多个靶点, 而后者则对TRK具有高度选择性。目前, 第一代TRK抑制剂larotrec-tinib/LOXO-101和entrectinib/RXDX-101分别于2018年和2019年获美国食品及药物管理局(FDA)批准, 其它TRK抑制剂如TSR-011、PLX7486、DS-6051b等尚在研究中。TRK抑制剂的临床研究不以患者肿瘤组织类型筛选受试者, 而通过特定分子特征甄别受试者, 即篮子试验(basket trial)。
larotrectinib是一种口服的高度选择性ATP竞争性抑制剂。临床前研究显示, larotrectinib可抑制含有MPRIP-NTRK1基因融合的肺腺癌细胞系中MPRIPTRKA蛋白和ERK1/2磷酸化, 对肿瘤细胞的增殖具有剂量依赖抑制作用[6]。2020年美国临床肿瘤学会(ASCO)年会报道了larotrectinib在3项临床试验(NCT02122913, NCT02576431, NCT02637687)的汇总结果, 共纳入116例患者(肺癌占12%), 客观缓解率(objective response rate, ORR)达71%[27]。与治疗相关的不良反应主要为1~2级, 其中1例患者因治疗相关的不良反应而终止治疗。另外, 研究发现接受larotrectinib治疗的NTRK基因融合阳性患者的生活质量显著改善[28]。Drilon等[29]报道了larotrectinib在11例转移性肺腺癌中的疗效, 其中7例可评估疗效, 结果显示完全缓解1例, 部分缓解4例, 疾病稳定2例, 与治疗相关的不良反应主要为1~2级。基于larotrectinib对NSCLC患者良好的疗效和安全性, 2019年第3版NCCN NSCLC指南推荐NTRK基因融合阳性的晚期患者可选择larotrectinib治疗[23]。
entrectinib是一种口服的广谱酪氨酸激酶抑制剂, 可靶向NTRK、ROS1和ALK基因融合, 其可通过血脑屏障, 对脑转移患者也有较好的疗效[30]。2020年ASCO年会报道entrectinib在74例患者(肺癌13例)中的ORR为63.5%, 在19例存在基线中枢神经系统受累的患者中ORR为57.9%[31], 常见的治疗相关3级不良反应主要为体重增加、贫血和疲劳。Paz-Ares等[32]报告了entrectinib在NSCLC中的3个临床研究(STARTRK-2、STARTRK-1、ALKA-372-001)汇总结果, 共纳入10例局部晚期或转移性NSCLC患者, ORR达到70%, 其中6例患者治疗前存在脑转移, 4例患者治疗后颅内病灶缩小。
与所有靶向药物类似, TRK抑制剂也面临着耐药问题。NTRK激酶区突变会引起TRK家族蛋白应用, 从而影响TRK抑制剂与靶标结合, 突变类型有G595R、G639R、F589L、F633L、G667C、G709C等[33]。其次, 使用TRK抑制剂后可激活其它致癌驱动基因和信号通路, 如Met扩增、KRAS突变、BRAF突变等[34]。为解决第一代TRK抑制剂的耐药问题, 目前第二代TRK抑制剂如LOXO-195、TPX-0005、ONO-5390556等已在研究中[35]。
05
结语和展望
NTRK基因融合在多种实体瘤的发生发展过程中发挥重要作用, 以基因型为导向的治疗模式的应用, 开辟出肿瘤治疗新的发展道路。NTRK基因融合的检测和TRK抑制剂的出现为NSCLC患者带来新的曙光。虽然NTRK基因融合在NSCLC中罕见, 但其在晚期难治性患者中意义重大。如何挑选出合适的患者以及如何更好地克服耐药问题, 仍是亟待解决的问题。
THE END





 个人中心
个人中心
 我是园区
我是园区




