Nat Comm | 王琦/薛蔚/程金科合作揭示SUMO修饰调控己糖激酶2亚细胞定位及其促癌作用
收藏
关键词:
揭示细胞Nat合作癌
资讯来源:BioArt + 订阅账号
发布时间:
2021-03-25

责编 | 酶美
肿瘤细胞的代谢编程往往不同于正常细胞,正常细胞在缺氧的情况下会进行糖酵解,而肿瘤细胞即使在不缺氧的情况下仍存在糖酵解途径的异常激活与线粒体呼吸受抑,这就是著名的Warburg效应。临床上根据该原理利用18FDG-PET/CT检查患者的糖摄取,由此判断肿瘤的全身分布。但迄今为止,对Warburg效应的分子机制仍是众说纷纭,有人认为糖代谢关键酶的异常表达可能是肿瘤细胞在复杂环境下得以生存的有力武器。己糖激酶是糖酵解过程中的第一个限速酶,广泛存在于各种细胞中,可催化葡萄糖转化为6-磷酸葡萄糖。在已知的己糖激酶家族中,目前认为己糖激酶的2(
HK 2
)
在许多肿瘤中高表达,并且可促进肿瘤细胞的增殖能力
【1】
。在细胞内,HK2可结合于线粒体外膜上阴离子通道蛋白VDAC1,该结合对HK2的致癌作用至关重要
【2】
。但是目前HK2与线粒体结合与解离的动态调控机制尚不明确。
近日,上海交通大学医学院附属仁济医院王琦研究员、薛蔚教授联合上海交通大学医学院基础医学院程金科教授在Nature Communications 在线发表了题为
SUMOylation controls the binding of hexokinase 2 to mitochondria and protects against prostate cancer tumorigenesis
的研究论文。
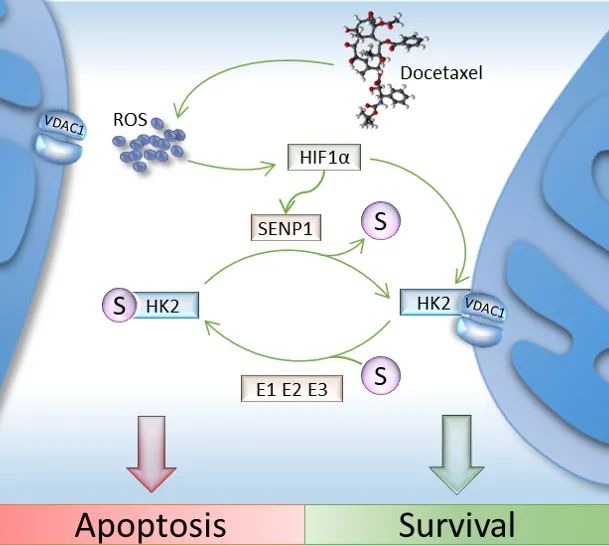
该研究发现HK2可以被类泛素蛋白SUMO修饰,并且深入探讨了SUMO修饰调控HK2与线粒体结合的具体分子机制及其在前列腺癌发生和治疗中的意义。
该团队首先通过蛋白三维结构预测,发现HK2可能被SUMO化修饰,随后通过免疫共沉淀等方法证实了该修饰,并且鉴定出修饰位点为第315和492位赖氨酸,且SUMO特异蛋白酶SENP1介导了HK2的去SUMO修饰。通过一系列实验发现,SUMO化修饰并不影响HK2蛋白的葡萄糖催化活性及蛋白稳定性。
研究人员进一步通过免疫荧光染色、线粒体分离等实验系统证明SUMO化修饰可以调节HK2与线粒体外膜阴离子通道蛋白VDAC1的结合。VDAC1是线粒体外膜上最丰富的离子通道蛋白之一,对线粒体功能具有举足轻重的影响。当HK2与SUMO共价结合后倾向于从线粒体外膜上解离,处于细胞质非线粒体组分中;而当SENP1介导HK2去SUMO修饰后,HK2则更容易与VDAC1结合,同时使细胞更倾向于糖酵解途径。尤为重要的是,在前列腺癌细胞中去SUMO修饰的HK2更能促进肿瘤细胞的增殖并保护细胞免受多西他赛化疗诱导的细胞凋亡的影响。此外,分析前列腺癌新辅助内分泌联合多西他赛化疗患者的组织芯片数据可见,SENP1-己糖激酶2轴的高表达与前列腺癌患者的预后呈负相关。
综上所述,该研究提供了癌细胞中HK2未发现的翻译后修饰的证据,并深入探讨了SUMO修饰调控HK2与线粒体结合的具体分子机制,对进一步了解前列腺癌细胞代谢重编程及预防前列腺癌化疗耐药具有重要指导意义。
本文还邀请南开大学张旺教授创作一幅画:SUMO在英语中有”相扑“之意,画中双关采用了日本相扑运动员代表SUMO蛋白,而挣脱了SUMO控制的小猴子(HK2)带着6颗糖果,得以与树(线粒体)上另一只小猴子(VDAC1)牵手。
上海交通大学医学院附属仁济医院泌尿科硕士研究生上官勋和基础医学院贺兼理博士为本论文的共同第一作者,上海交通大学医学院附属仁济医院泌尿科王琦研究员、薛蔚教授和基础医学院程金科教授为论文的共同通讯作者。
https://www.nature.com/articles/s41467-021-22163-7
1. K. C. Patra et al., Hexokinase 2 is required for tumor initiation and maintenance and its systemic deletion is therapeutic in mouse models of cancer. Cancer Cell 24, 213-228 (2013).
2. D. DeWaal et al., Hexokinase-2 depletion inhibits glycolysis and induces oxidative phosphorylation in hepatocellular carcinoma and sensitizes to metformin. Nat Commun 9, 446 (2018).
【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经允许禁止转载,作者拥有所有法定权利,违者必究。




 药选址
药选址



