▎药明康德内容团队报道
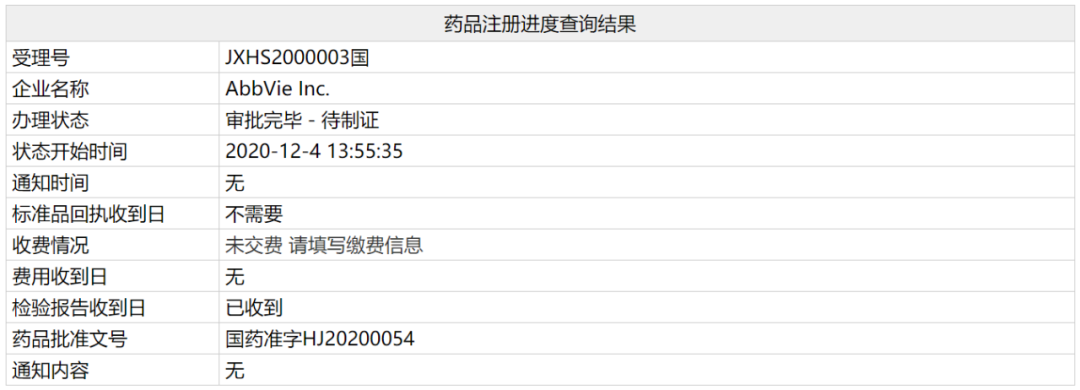
12月4日晚间,中国国家药监局官网信息显示,艾伯维(AbbVie)与罗氏(Roche)共同开发的BCL-2抑制剂维奈克拉片(venetoclax,ABT-199)的上市申请受理号已更新为“审批完毕-待制证”,并发布了批准文号。这意味着这款药物已经在中国获批。根据早前信息,此次获批适应症为,联合其它药物用于治疗年龄75岁及以上,或因合并症不适于接受强诱导化疗的新诊断的成人急性髓性白血病(AML)患者。
公开资料显示,维奈克拉是全球首个获得批准上市的BCL-2抑制剂,自问世以来曾5次被美国FDA授予突破性疗法认定。本次获批意味着这款突破性疗法终于惠及到中国患者,同时也标志着维奈克拉成为了首个在中国获批上市的BCL-2抑制剂。
BCL-2(B细胞淋巴瘤因子)是一种癌基因,具有抑制细胞凋亡的作用。BCL-2家族蛋白于上世纪80年代被发现,它通过与促凋亡蛋白BIM、BAD等形成二聚体以及自身二聚,在细胞凋亡的调控中发挥重要作用。但是研究发现,在有些血癌中,BCL-2蛋白的积累会导致肿瘤细胞无法进入细胞凋亡过程。此外,BCL-2蛋白的过度表达也与耐药性的形成有关。因此,BCL-2蛋白成为了血液癌症治疗的一个新靶标。
然而,以BCL-2为靶点的创新药物研发并不顺利。直到BCL-2蛋白被发现的三十年后,人类才迎来了首款获批的BCL-2抑制剂,它就是本次在中国获批的维奈克拉片。
维奈克拉是艾伯维与罗氏共同开发的一款“first-in-class”口服、选择性BCL-2抑制剂,它可通过选择性抑制BCL-2功能,重塑细胞的关键信号通路,让癌细胞自我毁灭,达到治疗肿瘤的目的。
2016年4月,维奈克拉在美国获批,成为了全球首个获批准上市的BCL-2抑制剂。目前,维奈克拉已在美国获批治疗慢性淋巴细胞白血病(CLL)、小淋巴细胞性淋巴瘤(SLL)、急性骨髓性白血病等多种适应症。由于维奈克拉治疗效果突出,FDA曾先后多次授予其突破性疗法认定。
在中国,维奈克拉的上市申请在2020年1月获得CDE受理,并在今年2月因“具有明显治疗优势创新药”被纳入优先审评。该药本次获批的适应症为:与阿扎胞苷,或地西他滨,或低剂量阿糖胞苷联用适于治疗年龄75岁及以上,或因合并症不适于接受强诱导化疗的新诊断的成人AML患者。
根据在维奈克拉在美国获批时的临床试验数据,维奈克拉联合疗法在治疗这类AML患者中具有良好的疗效和安全性。
在M14-358试验中,接受维奈克拉和阿扎胞苷组合疗法治疗的AML患者的完全缓解率(CR)为37%,完全缓解兼部分血细胞计数缓解率(CRh)为24%。
接受维奈克拉和地西他滨组合疗法治疗的患者的CR为54%
,CRh为8%。
M14-387试验结果表明,维奈克拉与低剂量阿糖胞苷联用,患者CR为21%,CRh为21%。
今年8月发表在《新英格兰医学杂志》上的一篇研究显示,维奈克拉与阿扎胞苷联用在一线治疗无法接受高强度化疗的AML患者的3期临床试验中达到了主要临床终点:与阿扎胞苷单药治疗相比,联合疗法将患者死亡风险降低34%,显著延长了患者的总生存期(OS)。
AML是最常见的急性白血病,发病者多为老年人。目前,对AML的标准治疗是强力诱导化疗,然后进行巩固化疗或者同种异体干细胞移植。然而,由于年龄、合并症、以及携带不良基因突变等原因,很多老年患者无法接受标准化疗或者对它们产生耐药性。维奈克拉的到来,为这些患者提供了新的选择。本次在中国获批意味着,这款突破性疗法终于可以惠及到中国AML患者,帮助他们改善生活质量。
值得一提的是,除了本次获批的适应症,目前维奈克拉已在中国获批多项临床研究,涉及的适应症包括慢性淋巴细胞性白血病成人患者、常规化疗后首次缓解的急性髓性白血病患者、异基因干细胞移植后的急性髓性白血病患者等等。期待这些临床研究也顺利进行,让维奈克拉惠及到更多的白血病患者。
版权说明:本文来自药明康德内容团队,欢迎个人转发至朋友圈,谢绝媒体或机构未经授权以任何形式转载至其他平台。转载授权请在「医药观澜」微信公众号留言联系我们。
欢迎扫码关注“医药观澜”微信公众号,了解更多中国医药创新动态。

注:本文旨在介绍医药健康研究进展,不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。
[1]中国国家药监局药品批准证明文件. Retrieved Dec. 13,2020, from
[2] Genentech Announces FDAGrants Venclexta Accelerated Approval for People With Newly-Diagnosed AcuteMyeloid Leukemia or Those Who Are Ineligible for Intensive InductionChemotherapy. Retrieved November 21, 2018, fromhttps://www.businesswire.com/news/home/20181121005534/en/Genentech-Announces-FDA-Grants-Venclexta-Accelerated-Approval
[3] New England Journal ofMedicine Publishes Positive Phase 3 Data of Venetoclax Combination in AcuteMyeloid Leukemia (AML) Patients. Retrieved August 14, 2020, from https://news.abbvie.com/news/press-releases/new-england-journal-medicine-publishes-positive-phase-3-data-venetoclax-combination-in-acute-myeloid-leukemia-aml-patients.htm










 个人中心
个人中心
 我是园区
我是园区




