3.20,两办印发《关于加强科技伦理治理的意见》
【临床研究】
3.21,科技部发布《人类遗传资源管理条例实施细则(征求意见稿)》
【新冠动态】
3.23,卫健委调整“奈玛特韦片/利托那韦片组合包装”(辉瑞Paxlovid)适应症等内容
3.25,CDE发布《化学仿制药参比制剂目录(第五十七批)》征求意见
【变更】
3.21,山东省局发布《药品审评共性问题百问百答 药品上市后变更篇(六)》
【中药】
3.22,国家中医药管理局发布《防范和惩治中医药统计造假弄虚作假责任制规定(试行)》
【医疗器械】
3.21,SAMR连发《医疗器械生产监督管理办法》和《医疗器械经营监督管理办法》及官方解读
3.24,NMPA发布《医疗器械质量管理体系年度自查报告编写指南》
3.24,NMPA发布《禁止委托生产医疗器械目录》
3.24,NMPA调整《医疗器械分类目录》部分内容
3.21,NMPA公布“2021医疗器械注册大数据”和“2021创新医疗器械一览表”
【新药批准和报产】
3.21-3.27,NMPA发布8个新药批准,包括复宏汉霖创新PD-1,CDE受理3个新药上市
(内容导读请在下列文本框中上下滑动查看)
【政策导向】
3.20,两办印发《关于加强科技伦理治理的意见》
本文出自中共中央办公厅和国务院办公厅,尽管未直接提及药品临床前研究和床研究中的伦理,但要求“制定生命科学、医学、人工智能等重点领域的科技伦理规范、指南等,完善科技伦理相关标准,明确科技伦理要求,引导科技机构和科技人员合规开展科技活动。” 业界可以关注接下来可能会陆续出台的伦理相关法规。
3.21,科技部发布《人类遗传资源管理条例实施细则(征求意见稿)》
2019年7月1日施行的《人类遗传资源管理条例》,终于迎来《实施细则》的征求意见稿,截至4月21日。
与药品临床申请相关的内容中,本细则对于“外方单位”做了详细阐述,限制了持股超过50%,以及持股未达50%但拥有决策权的境外主体在我国进行人类遗传资源的相关活动。这意味着,许多外资投资且“协议控制”(Variable Interest Entities)的Biotech公司临床研究可能遇阻。
此外,细则给出了“不需要审批”的具体情况:
第四十一条【国际合作备案条件】,为获得相关药品和医疗器械在我国上市许可,与中方单位合作在临床机构利用我国人类遗传资源开展国际合作临床试验、不涉及人类遗传资源材料出境的,符合以下情况需要将合作各方、拟使用的人类遗传资源种类、数量及其用途等向科技部备案,不需要审批:
(一)所涉及的人类遗传资源采集、检测、分析和剩余样本处理等在临床机构内进行的;
(二)所涉及的人类遗传资源在临床机构内采集,并由相关药品和医疗器械上市许可临床试验的临床试验方案指定的境内单位进行检测、分析和剩余样本处理的。
3.23,卫健委调整“奈玛特韦片/利托那韦片组合包装”(辉瑞Paxlovid)适应症等内容
该产品于2022年2月12日由NMPA应急附条件批准。
当时新闻稿中的适应症是“用于治疗成人伴有进展为重症高风险因素的轻至中度新型冠状病毒肺炎(COVID-19)患者,例如伴有高龄、慢性肾脏疾病、糖尿病、心血管疾病、慢性肺病等重症高风险因素的患者。”
国家卫健委3月15日印发的《诊疗方案》中,注明Paxlovid的适用人群为发病5天以内的轻型和普通型且伴有进展为重型高风险因素的成人和青少年(12-17岁,体重≥40kg)。
此次由卫健委发布调整,新适应症“为发病5天以内的轻型和普通型且伴有进展为重症高风险因素的成人。”去掉了青少年人群。
3.25,CDE发布《化学仿制药参比制剂目录(第五十七批)》征求意见
截止日前,NMPA已公布五十二批正式目录,CDE已发布五十七批征求意见。识林用户可至“参比制剂数据库”检索。
3.21,山东省局发布《药品审评共性问题百问百答 药品上市后变更篇(六)》
山东省局继续发布上市后变更问答,而且是业界喜闻乐见的缺陷案例清单的形式。
这次的“问答”,不只是化药药学,而是涉及《已上市化学药品和生物制品临床变更技术指导原则》和《已上市生物制品药学变更研究技术指导原则(试行)》。其中,生物制品变更涉及7种情形,多达数十项缺陷内容。
3.22,国家中医药管理局发布《防范和惩治中医药统计造假弄虚作假责任制规定(试行)》
本文标题耐人寻味,相信不会是例行公事,而是出现了不得不整治的问题与风险。
文中未具体说明是哪些“中医药统计”数据可能存在弄虚作假,不过读者可关注今年1月20日同样由中医药局发布的《2020年中医药事业发展统计提要报告》。无论如何,统计数据是宏观政策调整的坚实基础,中药传承创新,也离不开准确客观的数据。
【医疗器械】
3.21,SAMR连发《医疗器械生产监督管理办法》和《医疗器械经营监督管理办法》及官方解读
两项纲领性监管法规均曾于2021年3月26日征求意见,如今发布正式版,都将于5月1日生效。此外,NMPA还分别发布了解读文件。医疗器械企业必读。
其他与医疗器械有关的重点法规指南,均自5月1日起实施:
3.24,NMPA发布《医疗器械质量管理体系年度自查报告编写指南》
3.24,NMPA发布《禁止委托生产医疗器械目录》
3.24,NMPA调整《医疗器械分类目录》部分内容
3.21,NMPA公布“2021医疗器械注册大数据”和“2021创新医疗器械一览表”
NMPA以图片的形式展示了2021年医疗器械注册成果,其中比较突出的是创新医疗器械:
— 2021年,NMPA共批准35个创新医疗器械,比2020年增加35%;
— 2014年至2021年,共批准134个创新医疗器械。
3.21-3.27,NMPA发布8个新药批准,包括复宏汉霖创新PD-1 , CDE受理3个新药上市
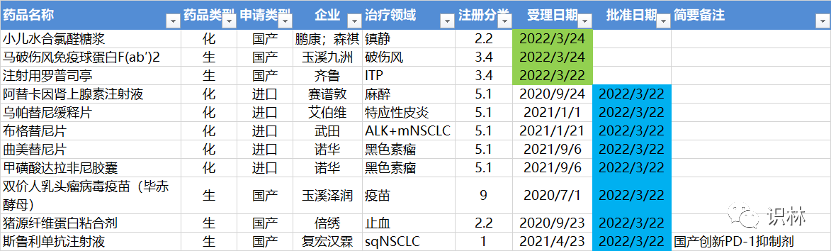
CDE受理3个新药上市申请。
注:仅列出新药(包括改良型新药和生物类似药)的上市申请和批准上市信息。在“以临床价值为导向”的背景下,申请上市以及获批的品种,其适应症、临床研究策略、注册路径,都值得业界关注和分析。
作者:识林-实木


长按下方二维码下载识林®App

识林®版权所有,未经许可不得转载。



 个人中心
个人中心
 我是园区
我是园区




