▎药明康德内容团队报道
中国国家药监局(NMPA)最新公示显示,默沙东(MSD)重磅PD-1抑制剂帕博利珠单抗注射液(Keytruda,pembrolizumab)的新适应症
已在中国获批。公开资料显示,这是帕博利珠单抗在中国获批的第8项适应症,用于食管癌一线治疗。



在全球范围内,食管癌是导致癌症死亡的一大重要
原因,而中国是食管癌多发的国家。此前,
已经有多款癌症免疫疗法获得监管批准,用于食管癌二线治疗。然而,转移性
食管癌的一线治疗在过去约40年里都进展甚微
,一直以氟嘧啶联合铂类化疗为主。转移性食管癌的死亡率仍然很高。
帕博利珠单抗是默沙东开发的一款重磅PD-1抑制剂,它通过阻断PD-1/PD-L1信号通路,提高人体免疫细胞的抗癌反应。自从该肿瘤免疫新药问世以来,它已在全球获得批准用于治疗多种癌症类型,包括早前已在中国获批的7项适应症,涵盖黑色素瘤、非小细胞肺癌、头颈部鳞状细胞癌、结直肠癌及食管癌二线治疗。
2020年11月23日,帕博利珠单抗在中国递交新适应症并获得受理。据悉,该项申请针对的新适应症为食管癌一线治疗。
值得一提的是,美国FDA已于2021年3月
帕博利珠单抗与含铂和氟嘧啶化疗联用,一线治疗局部晚期或转移性食管癌或胃食管连接部(GEJ)腺癌患者。这些患者不适于接受手术切除治疗或者确定性化学放射治疗。默沙东曾在新闻稿指出,这是首个获得FDA批准用于一线治疗这一患者群的抗PD-1免疫组合疗法,代表着食管癌一线治疗方面近30年来的重大突破。
该批准基于一项名为KEYNOTE-590的3期临床试验结果。这是一项随机、安慰剂对照、双盲、3期研究,在26个国家的168个医疗中心开展,招募了未经治疗的局部晚期、不可切除或转移性食管癌或Siewert 1型胃食管结合部癌成人患者(不限PD-L1状态)。共有749例患者1:1随机分组接受帕博利珠单抗联合化疗或安慰剂联合化疗。
就在几日前,KEYNOTE-590
发表在《柳叶刀》。研究显示
,
帕博利珠单抗联合化疗一线治疗晚期食管癌患者,相较于化疗将死亡风险降低27%,疾病进展或死亡风险降低35%,且无论患者组织学如何都能获益。值得注意的是,KEYNOTE-590纳入了多元化的全球人群,这些数据可适用于全球范围内的患者,
而且在亚洲患者中观察到了更大的生存获益(死亡风险降低36%)。
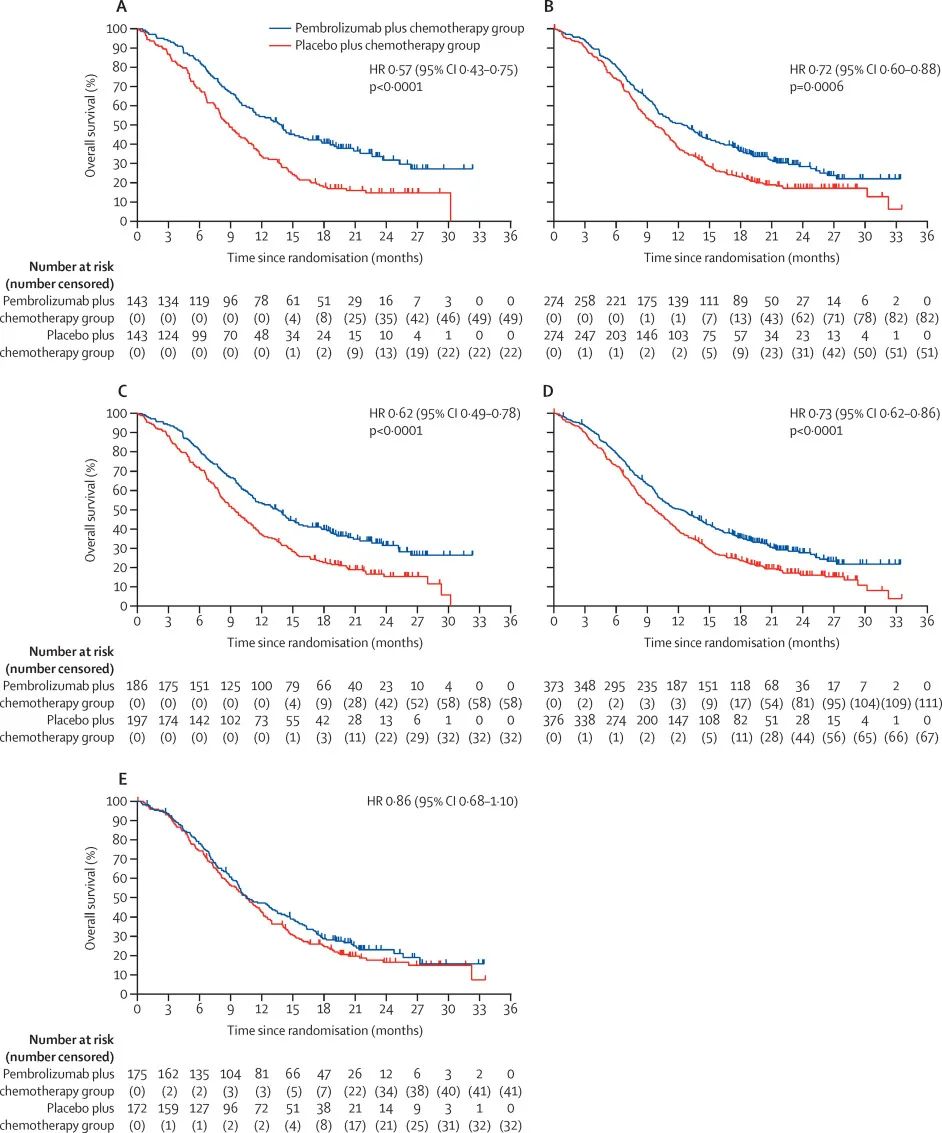
▲不同特点的患者,接受帕博利珠单抗联合化疗(蓝线),总生存期都更长。(A)食管鳞癌且PD-L1 CPS≥10,(B)食管鳞癌,(C)PD-L1 CPS≥10,(D)所有随机分组的患者,(E)PD-L1 CPS<10。(图片来源:参考资料[3])
论文中指出,总体来看,帕博利珠单抗联合化疗组的生存数据在治疗早期就与化疗组拉开了差距,而且随着时间推移持续保持生存优势。
另外,帕博利珠单抗联合化疗的安全性可控,与单独化疗相比,没有新的安全信号报告。
据默沙东早前新闻稿介绍,在过去30年里,一线治疗食管癌在改善患者生存方面鲜有进展。尽管目前新确诊的食管癌和GEJ癌患者有可用的治疗方案,然而他们预后较差。帕博利珠单抗与化疗构成的组合疗法,有望为患者带来新的一线治疗选择。
祝贺默沙东帕博利珠单抗在中国获批的新适应症,希望这一批准能让更多癌症患者获益。
相关阅读:
注:本文旨在介绍医药健康研究进展,不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。
参考资料:
[1]2021年09月03日药品批准证明文件待领取信息发布 . Retrieved Sep 3,2021, from https://www.nmpa.gov.cn/zwfw/sdxx/sdxxyp/yppjfb/20210903084004127.html
[2] FDA Approves Merck’s KEYTRUDA® (pembrolizumab) PlusPlatinum- and Fluoropyrimidine-Based Chemotherapy for Treatment of CertainPatients With Locally Advanced or Metastatic Esophageal or GastroesophagealJunction (GEJ) Carcinoma. Retrieved March 23, 2021, from https://www.businesswire.com/news/home/20210323005359/en
[3] Jong-Mu Sun, et al., (2021). Pembrolizumab plus chemotherapy versus chemotherapy alone for first-line treatment of advanced oesophageal cancer (KEYNOTE-590): a randomised, placebo-controlled, phase 3 study. Lancet, DOI: https://doi.org/10.1016/S0140-6736(21)01234-4
版权说明:本文来自药明康德内容团队,欢迎个人转发至朋友圈,谢绝媒体或机构未经授权以任何形式转载至其他平台。转载授权请在「医药观澜」微信公众号留言联系我们。










 个人中心
个人中心
 我是园区
我是园区




