
来源:iNature
胆道闭锁(BA)是由肝外胆管阻塞介导的严重胆管疾病,在婴儿早期引起病理性黄疸和肝功能衰竭。胆道闭锁的发病率因地域而异,每5,000–18,000个活产儿中就有1个发生。诊断后需要进行肝门肠造口术(Kasai手术)以清除残留的导管。如果不进行治疗,胆道闭锁通常在1年内迅速发展为终末期肝硬化。胆道闭锁(BA)是一种严重的胆管疾病,可导致婴儿肝衰竭,但其发病机理仍有待充分表征。
2020年11月27日,广州医科大学,北京大学,中山大学等多单位合作,张玉霞,温哲,夏慧敏及白凡(广州医科大学为第一单位)共同通讯在Cell 在线发表题为“Liver Immune Profiling Reveals Pathogenesis and Therapeutics for Biliary Atresia”的研究论文,该研究通过单细胞RNA谱分析,观察到胆道闭锁患儿的巨噬细胞低炎症,库普弗细胞清除功能缺陷,细胞毒性T细胞扩增以及CX3CR1 +效应子T和自然杀伤(NK)细胞缺乏。
更重要的是,该研究发现出生后肝B细胞淋巴细胞生成没有停止,并且耐受性缺陷促成了胆道闭锁中免疫球蛋白G(IgG)-自身抗体的积累。在恒河猴轮状病毒诱导的胆道闭锁模型中,消耗B细胞或阻断抗原呈递可减轻肝脏损害。在一项初步的临床研究中,该研究证明了利妥昔单抗可有效清除肝B细胞并将巨噬细胞,库普弗细胞和T细胞的功能恢复到与对照组相当的水平。总而言之,该研究对胆道闭锁婴儿的全面免疫分析表明,B细胞修饰疗法可以缓解肝脏病理。
另外,2020年6月10日,广州医科大学赵金存,爱荷华大学Stanley Perlman及Paul B. McCray Jr.共同通讯在Cell 在线发表题为“Generation of a Broadly Useful Model for COVID-19 Pathogenesis Vaccination, and Treatment”的研究论文,该研究通过复制缺陷型腺病毒(Ad5-hACE2)外源递送人ACE2开发了小鼠模型。Ad5-hACE2的小鼠出现了肺炎,其特征在于体重减轻,严重的肺部病理以及肺部高滴度病毒复制。I型干扰素,T细胞,信号转导和转录激活因子1(STAT1)对于这些小鼠的病毒清除和疾病解决至关重要。Ad5-hACE2转导的小鼠能够快速评估候选疫苗,人类恢复期血浆以及两种抗病毒疗法(poly I:C和remdesivir)。总之,该研究描述了一种具有广泛和直接实用性的鼠模型,以研究COVID-19的发病机理,并评估新的疗法和疫苗。
2020年4月25日,澳门科技大学,四川大学,广州医科大学,清华大学,中山大学等多机构联手合作,张康,王光宇,林天歆,何健行,李为民作为通讯在Cell 在线发表题为“Clinically Applicable AI System for Accurate Diagnosis, Quantitative Measurements and Prognosis of COVID-19 Pneumonia Using Computed Tomography”的研究论文,该研究使用来自4154名患者的大型计算机断层扫描(CT)数据库,开发了可以诊断新冠肺炎并将其与其他常见肺炎和正常对照区分开的AI系统。
AI系统可以帮助放射科医生和医生进行快速诊断,尤其是在医疗系统超负荷的情况下。重要的是,该研究的AI系统识别了与新冠肺炎病变特性相关的重要临床标志物。连同临床数据,AI系统能够提供准确的临床预后,可以帮助临床医生考虑适当的早期临床治疗并适当地分配资源。该研究已经在全球范围内提供了此AI系统,以协助临床医生应对COVID-19。
2019年11月14日,广州医科大学张玉霞、杨敏、龚四堂等与北京大学白凡课题组合作共同通讯在Cell 在线发表题为"Mucosal Profiling of Pediatric-Onset Colitis and IBD Reveals Common Pathogenics and Therapeutic Pathways"的研究论文,该研究报告了未分化结肠炎,克罗恩病和溃疡性结肠炎患儿的单细胞聚类,免疫表型分析和风险基因分析。该研究发现在结肠炎和IBD患者中,常见的是表达PDE4B和TNF的巨噬细胞浸润,表达CD39的上皮内T细胞减少,结肠黏膜血小板聚集和5-羟色胺释放。在一项先导研究中,通过使用磷酸二酯酶抑制剂双嘧达莫来靶向这些途径可恢复免疫稳态并改善结肠炎症状。总而言之,对结肠粘膜的全面分析发现了结肠炎和IBD儿童的常见发病机制和治疗目标。
2018年3月9日,中科院基因组所刘江、山东大学陈子江与广州医科大学三附院刘见桥研究组合作在Cell发表题为“Chromatin Accessibility Landscape in Human Early Embryos and Its Association with Evolution”的研究论文,该研究首次报道人类早期胚胎染色质动态图谱,同时这些数据为理解基因和转座子表达的调节提供了进化的发展观。
2018年2月23日,广州医科大学/广州市妇女儿童医疗中心基因检测中心、临床数据中心、医学影像部及眼科等科研团队研发的新一代医用人工智能(AI)平台应用成果“Identifying Medical Diagnoses and Treatable Diseases by Image-Based Deep Learning ”在世界顶级期刊Cell 以封面文章的形式发表。

胆道闭锁(BA)是由肝外胆管阻塞介导的严重胆管疾病,在婴儿早期引起病理性黄疸和肝功能衰竭。胆道闭锁的发病率因地域而异,每5,000–18,000个活产儿中就有1个发生。来自发育和环境起源的多因素病原学因素促进了疾病的发展。诊断后需要进行肝门肠造口术(Kasai手术)以清除残留的导管。如果不进行治疗,胆道闭锁通常在1年内迅速发展为终末期肝硬化。
Kasai手术后,由于肝硬化,大约有50%的胆道闭锁患者将在生命的头2年内需要进行肝移植,其余大部分依靠其天然肝脏的儿童将遭受长期并发症的困扰,包括反复发生的胆管炎,门脉高血压,食管静脉曲张破裂出血和肝性骨营养不良。
病毒相关的胆管自身免疫破坏被认为是胆道闭锁发病的重要原因。在胆道闭锁患儿中,CD68 +巨噬细胞和分泌干扰素-γ(IFN-γ)的CD4 +和CD8 + T细胞聚集在门道周围和胆管上皮。在恒河猴轮状病毒(RRV)诱导的胆道闭锁小鼠模型中,阻断IFN-γ的产生阻止了肝外胆管的炎性和纤维化阻塞。
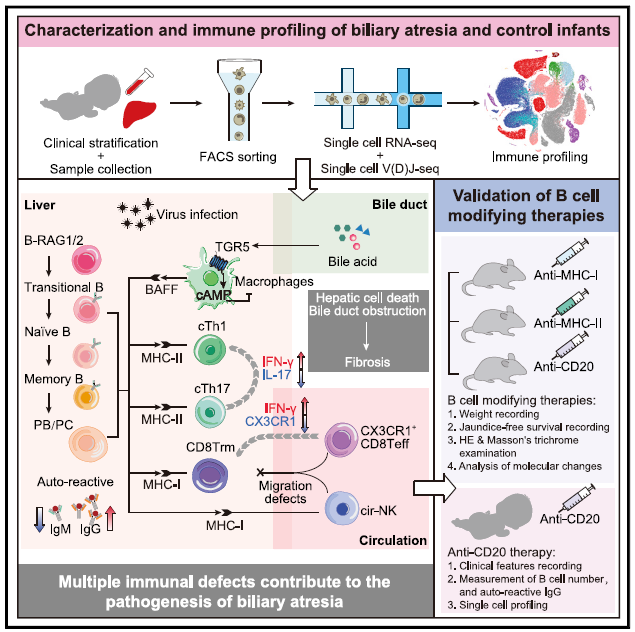
文章模式图(图源自Cell )
对胆道闭锁婴儿的T细胞受体(TCR)β链可变区的分析未发现浸润性CD4 +和CD8 + T细胞的寡克隆扩增。此外,胆道闭锁患者的胆道残余物中的免疫球蛋白(Ig)谱也是寡克隆的。沿胆管上皮基底沉积的IgM和IgG自身抗体和靶向上皮α-烯醇酶的自身抗体已显示与胆道闭锁婴儿的病毒抗原发生交叉反应。胆道闭锁婴儿的循环中自身抗体也高度升高。尽管有上述信息,尚未建立导致胆道闭锁婴儿快速肝衰竭的免疫功能障碍的全面描述。
在这项研究中,对胆道闭锁婴儿的肝活检和血液中的单核免疫细胞进行了分析,并在单细胞分辨率下将其与对照对象进行了比较。该研究确定了42个细胞亚群,包括组织驻留和循环的常规(CD4 +和CD8 + T)和非常规的T细胞,B细胞,先天性淋巴样细胞,单核细胞,巨噬细胞,树突状细胞(DC)和库普弗细胞。
重要的是,该研究表明肝脏中的B细胞淋巴细胞生成已延伸至出生后,至少持续了生命的最初几个月。这些B细胞形成功能性枢纽,其失调导致胆道闭锁婴儿自身抗体蓄积和肝功能衰竭。该研究提供的临床前和临床证据表明,B细胞修饰疗法可用于恢复胆道闭锁婴儿的肝免疫功能。
参考消息:
https://doi.org/10.1016/j.cell.2020.10.048




 个人中心
个人中心
 我是园区
我是园区




