

经过30年的积淀发展,张江从园到城,从产业培育、孵化到产业集聚,践行“探索创新、追逐梦想”的张江人也主动成为源头创新的探路先锋。中国创新药产业更是在这里从无到有,全球或全国多个“第一”产品在张江诞生。
今年11月,“2022上海国际生物医药产业周--张江生命科学国际创新峰会”将在张江科学城举办,本届峰会主题为“聚势而立•链接全球”,以张江科学城成立30周年为契机,聚焦生命科学产业新技术、新模式、新领域,跨界融合发展趋势背景,立足张江、链接全球。
2021年10月12-15日,在主题为“创新策源 共享开放”的“2021上海国际生物医药产业周——张江生命科学国际创新峰会”上,张江生物医药创新成果进行了首次公开展示,引发关注。
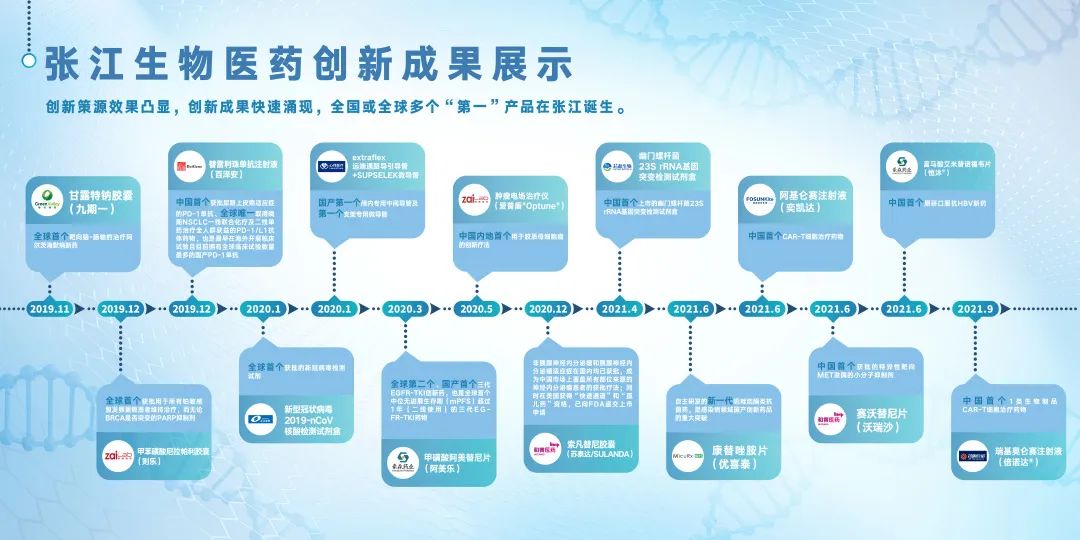

去年峰会后,张江又有诞生了哪些阶段性创新成果,可能会成为未来的“第一”?让我们一起来盘点一下吧!
2021.10.27 恒瑞医药PD-L1治疗广泛期小细胞肺癌III期临床成功
恒瑞医药1类新药PD-L1单抗SHR-1316(阿得贝利单抗注射液)联合化疗一线治疗广泛期小细胞肺癌的随机、双盲、安慰剂对照、多中心的III期临床研究(SHR-1316-III-301)主要研究终点结果达到方案预设的优效标准;目前“阿得贝利单抗注射液”的上市申请已获CDE受理。
2021.12.17 赛默罗生物首个国际多中心临床II期研究获得美国FDA批准
赛默罗生物自主研发、外周神经病理痛候选药物SR419的国际多中心II期临床研究已获得美国食品药品监督管理局 (FDA)批准。
2022.1.11 FDA 授予西比曼C-CAR039再生医学先进疗法 ( RMAT) 和快速通道(FT)资格
FDA授予西比曼生物科技公司细胞治疗产品C-CAR039再生医学先进疗法资格和快速通道资格,用于治疗复发或难治性及弥漫性大B细胞淋巴瘤。在2021年6月,C-CAR039已被美国食品和药物管理局 (FDA)授予孤儿药认定 (ODD),用于治疗滤泡性淋巴瘤,一种惰性形式的非霍奇金淋巴瘤。同年12月10日FDA正式批准了C-CAR039的IND申请。
2022.2.24 亿一生物F-627获得新药上市申请受理
亿帆医药子公司亿一生物的F-627获得国家药监局(NMPA)新药上市申请受理。F-627是开发的一种长效粒细胞集落刺激因子(G-CSF),拟开发用于治疗化疗致中性粒细胞减少症(CIN)。此前,该药已在美国和欧盟递交上市申请,并获得受理。
2022.3.22 亚盛医药原创新药获得美国FDA授予的儿童罕见病资格认证。
亚盛医药在研原创新药MDM2-p53抑制剂APG-115(alrizomadlin)获得美国FDA授予的儿童罕见病资格认证,用于治疗神经母细胞瘤,APG-115已获得FDA授予的1项快速通道资格、6项孤儿药资格和2项儿童罕见病资格认证。
2022.3.28 和铂医药全球首个B7-H4/4-1BB双抗获批临床
和铂医药B7-H4/4-1BB双抗国内临床申请获受理,用于治疗实体瘤。2月,和铂医药宣布B7-H4/4-1BB双抗新药HBM7008获得澳大利亚批准临床,HBM7008为全球首个B7-H4/4-1BB双抗。
2022.4.8 爱科百发RSV药物成功完成III期临床试验
爱科百发研发的治疗呼吸道合胞病毒(RSV)感染药物爱司韦™(通用名:齐瑞索韦/ziresovir)在一项多中心III期临床试验获得积极结果,达到主要终点及关键次要终点。此项研究是全球首个获得积极结果的口服RSV抗病毒药物III期临床试验。
2022.4.20 瑞石生物SHR0302片用于治疗斑秃的III期临床试验完成首例患者给药
瑞石生物在研的SHR0302片(一种高选择性JAK1抑制剂)用于治疗斑秃的III期临床试验在江西省皮肤病专科医院完成了中国地区首例患者入组及给药。这是继2021年8月SHR0302片针对斑秃患者的随机、双盲、安慰剂对照、国际多中心(中国、美国、澳洲)的II期临床试验达到研究终点后的又一个里程碑。
2022.4.22 沙砾生物国内首个肿瘤浸润淋巴细胞药物获批临床
沙砾生物自主研发的GT101注射液获得NMPA的临床试验默示许可,这是国内首个获批临床的肿瘤浸润淋巴细胞药物。
2022.5.23 君实 VV116 头对头 Paxlovid 成功
君实生物与苏州旺山旺水合作开发的新冠口服药 Renmindevir(VV116/JT001)头对头对比辉瑞Paxlovid用于轻中度新型冠状病毒肺炎早期治疗的 III 期注册临床研究(NCT05341609)达到方案预设的主要终点,并向国家药监局提交了上市申请。
2022.6.06 和誉医药国内首个泛FGFR抑制剂与肿瘤免疫药物的联合用药临床试验获批
和誉医药在研泛FGFR抑制剂ABSK091与百济神州的抗PD-1抗体替雷利珠单抗的联合用药方案,获得NMPA临床研究许可,即将开展针对尿路上皮癌的II期临床试验。这是中国境内首个泛FGFR抑制剂与肿瘤免疫药物的联合用药临床试验。
2022.6.15 凡恩世生物双特异性抗体获得FDA临床试验批准
凡恩世生物的在研产品潜在“first-in-class”创新药——Claudin18.2/CD47双特异性抗体PT886已获得美国FDA临床试验批准,将在胃癌、胃食管交界处癌和胰腺癌患者中开展Ⅰ期临床试验。
2022.6.15 翰森制药阿美替尼获得中国境外首个上市许可申请
英国药品和医疗保健用品管理局(MHRA)正式受理翰森制药合作伙伴EQRx递交的第三代表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)阿美替尼,一线治疗具有EGFR敏感突变的阳性局部晚期或转移性非小细胞肺癌(NSCLC), 及用于治疗既往经EGFR-TKI治疗进展且T790M突变阳性的局部晚期或转移性NSCLC的上市许可申请。这是阿美替尼在中国境外的首个上市许可申请。
2022.6.16 宜明昂科全球首个靶向人CD47xHER2的双靶点抗体-受体重组蛋白药物获得美国专利局授权
宜明昂科全球首个靶向人CD47xHER2的双靶点抗体-受体重组蛋白药物,获得美国专利局授权。此前(2021年),该药物的临床研究申请(IND)获美国FDA受理。其主要的适应症包括Her2阳性的乳腺癌、胃癌、肺癌等实体肿瘤。
2022.7.28 科越医药双功能抗体融合蛋白获FDA孤儿药认定
FDA已批准科越医药具有独特作用机制的全球首创的双功能补体类生物药KP104孤儿药认定,用于治疗阵发性睡眠性血红蛋白尿症(PNH)。
2022.7.28 英矽智能开发的首个由人工智能发现和设计的候选药物完成国内I期临床试验首次给药
英矽智能首个在中国进入临床试验阶段的、由AI发现和设计的候选药物ISM001-055完成I期临床试验中的首次健康受试者给药,用于治疗特发性肺纤维化。
2022.9.5 迪哲医药舒沃替尼治疗EGFR20号外显子插入突变晚期非小细胞肺癌中国注册临床达主要终点
欧洲肿瘤内科学会(ESMO)年会上,公布了迪哲医药的舒沃替尼针对既往接受过铂类化疗、携带EGFR 20号外显子插入突变的晚期非小细胞肺癌(NSCLC)患者的首个注册研究WU-KONG6达到主要终点,临床结果令人振奋。
2022.9.12 和黄医药呋喹替尼胶囊国际III期注册临床试验均达到顶线结果
和记黄埔医药(上海)有限公司自主研发的一类抗肿瘤创新药——呋喹替尼胶囊,2018年9月在中国获批上市,用于治疗转移性结直肠癌患者;2020年9月在全球14个国家150个中心启动了Fresco-2国际III期注册临床试验;2022年8月8日,Fresco-2国际III期注册临床试验均达到顶线结果,并于2022年9月12日在法国巴黎举办的欧洲肿瘤内科学会(ESMO)上正式公布。
2022.9.17 康景生物研发的全球新靶点补体抑制剂CG001的获得FDA的IND申请
美国食品和药物管理局(FDA)正式批准补体系统创新药物的研发企业--康景生物研发的全球新靶点first-in-class补体抑制剂CG001的新药临床研究(IND)申请。CG001是该公司第一款补体抑制剂,目前CG001的国内I期临床试验正在北京协和医院有序开展中,另有多款补体系统创新药物在研。
2022.9.19 德琪医药PD-L1/4-1BB双特异性抗体获得FDA孤儿药资格认定
德琪医药自主开发的新型PD-L1/4-1BB双特异性抗体ATG-101获美国食品药品监督管理局(FDA)孤儿药资格认定,用于治疗胰腺癌。目前全球尚无获批用于治疗胰腺癌的PD-L1/4-1BB双特异性抗体。




 个人中心
个人中心
 我是园区
我是园区





