4月2日,Supernus公司宣布,FDA已批准该公司Qelbree(viloxazine缓释胶囊) 上市,用于治疗6-17岁儿童注意力缺陷多动障碍(ADHD)。Qelbree是近10年来FDA批准的首个新型非兴奋剂类ADHD药物。
Qelbree是一种具有选择性5-羟色胺调节活性的去甲肾上腺素再摄取抑制剂(NET),这一药物已在欧洲作为抗抑郁药物销售多年,其安全性也得到了广泛验证。
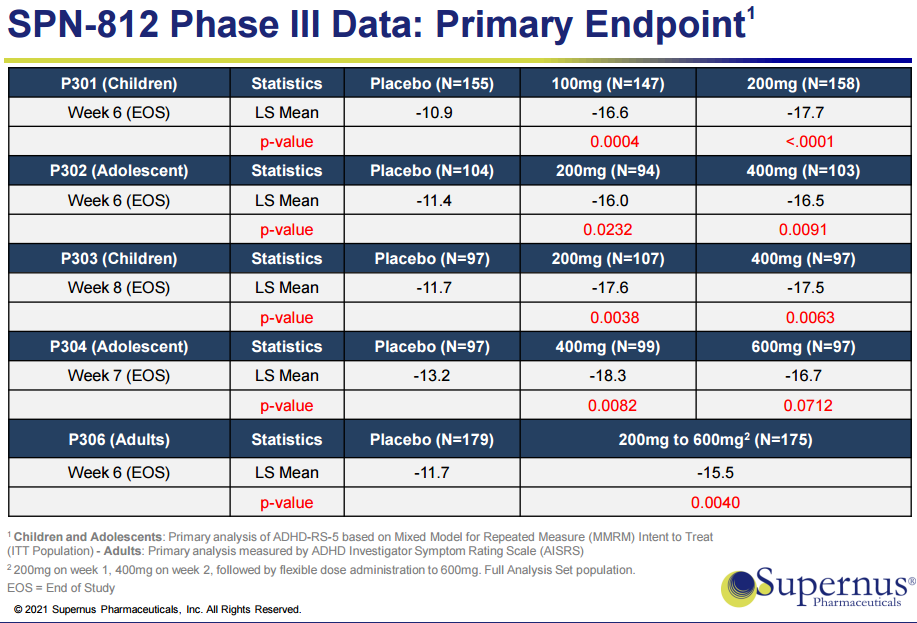
Qelbree的批准是基于一项针对儿童患者4个III期临床试验(P301、P302、P303、P04)项目的数据支持,该项目评估了Qelbree对超过1000例 6-17岁儿童ADHD患者的疗效。
研究结果显示,4项研究均达到主要终点,Qelbree不同剂量组患者ADHD 5级评定量
表(ADHD Rating Scale-5)评分较基线变化值与安慰剂组有显著性差异,患者多动/冲动和注意力不集中症状得到显著改善。
针对儿童和成人的5项III期临床研究均达到主要终点
此外,2020年12月,针对成人ADHD患者的一项III期临床试验也获得了积极结果,Supernus计划于2021年下半年向FDA提交Qelbree用于成人的补充新药申请(sNDA)。
纽约州立大学医学院精神病学临床副教授、神经科学教育研究所首席医学官 Andrew J. Cutler博士表示,A
DHD是美国最常见的心理健康问题之一,Qelbree的批准为这些患者提供了一个新型每日1次非兴奋剂疗法,这对于患有多动症的儿童和青少年来说是一个很好的选择。
点亮“在看”,好文相伴





 药选址
药选址



