2021年7月20日,嘉和生物宣布旗下GB491(Lerociclib),细胞周期蛋白依赖性激酶(CDK) 4/6抑制剂,获得国家药品监督管理局(NMPA)临床试验默示许可,批准开展两项用于乳腺癌治疗的三期临床试验。
此次获得批准开展的两项临床试验分别为:一线联合来曲唑治疗既往未经过系统性抗肿瘤治疗的激素受体(HR)阳性、人表皮生长因子受体2(HER2)阴性的局部晚期或转移性乳腺癌受试者的多中心、随机双盲、安慰剂对照3期临床试验;以及二线联合氟维司群治疗既往接受内分泌治疗后疾病进展的激素受体(HR)阳性,人表皮生长因子受体2(HER2)阴性的局部晚期或转移性乳腺癌受试者多中心、随机双盲、安慰剂对照三期临床试验。
Lerociclib是一种差异化的口服CDK4/6抑制剂,开发用于与其他靶向药物联合治疗某些类型的乳腺癌和肺癌患者。2020年6月22日,嘉和生物(GenorBiopharma)与G1 Therapeutics宣布在亚太地区(日本除外)开发和商业化GB491(Lerociclib)的独家许可协议。
据资料显示,此次获得许可开展的这两项临床试验分别于2021年5月递交申请,并计划于2021年4季度完成首位患者入组。
CDK4/6抑制剂已经成为HR+/HER2-晚期乳腺癌的一种标准治疗方法,给乳腺癌患者带来显著的临床获益
据2021年1月世界卫生组织国际癌症研究机构(IARC)发布的全球最新癌症数据显示,乳腺癌已超越肺癌成为全球第一大癌。在我国晚期乳腺癌患者的5年生存率只有20%,总体中位生存时间为2-3年,明显低于发达国家,其中占比最大的是HR+/HER2-型患者。
全球首个CDK4/6抑制剂哌柏西利在2015年获得FDA批准上市,自此,HR+/HER2-晚期乳腺癌的临床治疗格局发生革命性的变化。
据Nature统计,2019年全球乳腺癌市场总额为202亿美元,其中HER2靶向药物和CDK4/6抑制剂销售额占乳腺癌药物总销售额的68%,Nature预测未来全球乳腺癌市场在2029年可达477亿美元。
面对全球巨大的市场前景,CDK4/6抑制剂成为近年来各大企业争相布局的热门靶点。目前,全球共有四款CDK4/6抑制剂获批上市(见表1),除获批骨髓抑制适应症的 Trilaciclib 之外,另外 3 款均用于治疗 HR+/HER2-乳腺癌。

现如今,全球CDK4/6抑制剂项目研发共24项(见表2),已上市4款药物,其余20项还在临床研究中。其中,礼来Abemaciclib薄膜包衣片剂、诺华Ribocicib薄膜包衣片剂与辉瑞Palbociclib胶囊的三款上市药物虽生物靶点相同,Palbociclib和Ribocicib血液系统毒性较为严重;Abemaciclib与前两者相比血液系统毒性相对少见、但腹泻更为严重。Ribocicib肝毒性最为常见。恒瑞医药SHR6390片联合氟维司群可显著延长经内分泌治疗后进展的HR+/HER2-复发或转移性乳腺癌患者的无进展生存期。辉瑞Palbociclib联合来曲唑使绝经后进展期或转移性乳腺癌、既往未接受针对晚期系统性治疗的ER+/HER2-晚期乳腺癌患者无进展生存期增加一倍。

GB491在HR+╱HER2-乳腺癌的多个临床前模型及临床试验中均证明其优越疗效。临床数据显示,其客观缓解率(ORR)为31.6%、疾病控制率(DCR)79%,疗效显著。
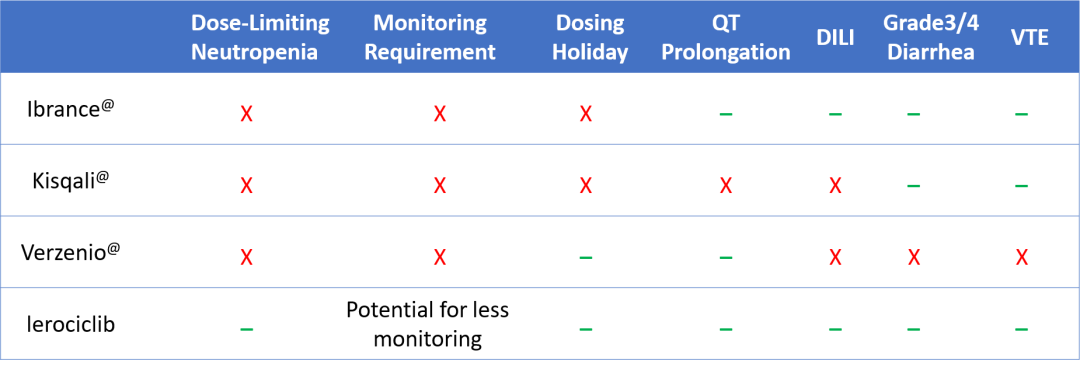
GB491(Lerociclib)具有更好的安全耐受性
GB491相比其他产品(见表3)具备不需要用药间歇、无明显剂量限制性中性粒细胞减少、胃肠道毒性减少、无严重肝毒性、减少临床监测的可能性等特性,具有良好的安全性与耐受性。
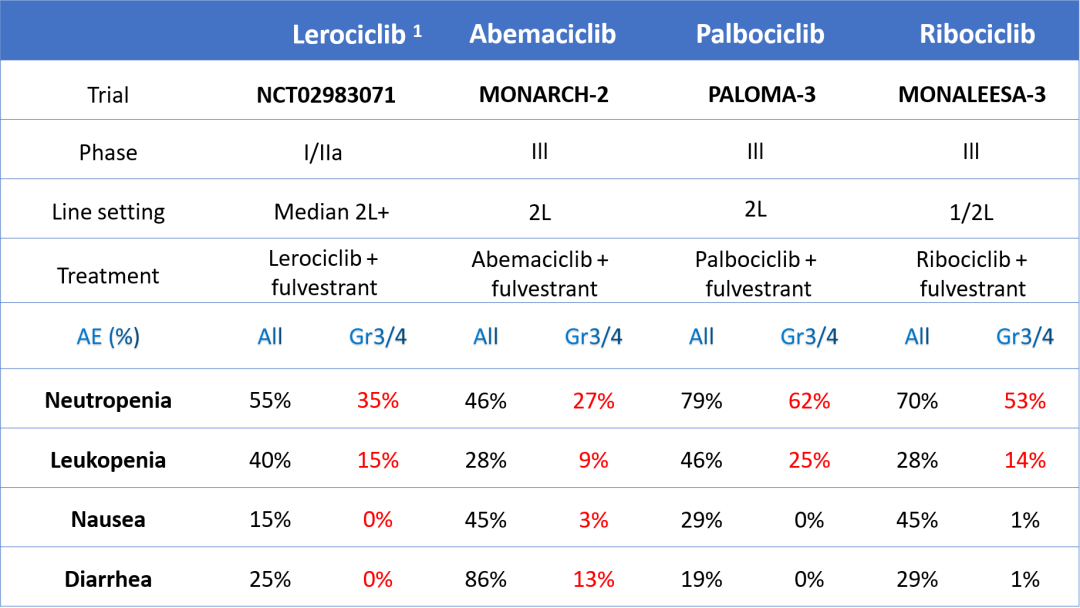
在所有的不良事件(AE)里(见表4)嗜中性粒细胞减少症发生率为55%、白细胞减少症40%、恶心15%、腹泻25%;出现Gr3/4的AE里嗜中性粒细胞减少症发生率为35%、白细胞减少症15%、无恶心和腹泻。对比其他三种药物AE发生率,Lerociclib可能是所有CDK4/6药物类中最安全的。
表4 Lerociclib可能是最安全的CDK4/6药物
嘉和生物GB491(Lerociclib)是一种具有显著差异化的口服CDK4/6抑制剂,适用于治疗HR+╱HER2-晚期或转移性乳腺癌患者。该产品在可评价人群中ORR达到31.6%,治疗效果显著;较低的剂量限制性毒性与临床使用中低频率监测不良反应为其带来较高的耐受性;出现3级及以上中性粒细胞减少的比例低于哌柏西利及Ribociclib,出现腹泻的比例远低于阿贝西利,恶心、呕吐发生率不高,且均为1或2级。相比于其他已上市CDK4/6抑制剂体现了更好的安全性;因其较高的耐受性与安全性可以连续不间断地给药,从而降低了肿瘤复发和耐药发生的可能。根据以上数据,GB491有望成为潜在的最佳CDK4/6抑制剂药物。
识别微信二维码,添加生物制品圈小编,符合条件者即可加入生物制品微信群!


本公众号所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系(cbplib@163.com),我们将立即进行删除处理。所有文章仅代表作者观点,不代表本站立场。











 个人中心
个人中心
 我是园区
我是园区




