摘要:近几十年来,肿瘤治疗领域取得了很大的进展。特别是以肿瘤相关抗原(TAA)为靶点的细胞治疗技术得到了长足的发展。通过产生由编码单链抗体(scFv)、共刺激结构域(CD28或TNFRSF9)和用于T细胞增殖和激活的CD247信号结构域的基因组成的CAR构建体,使T细胞具有攻击肿瘤细胞的能力。最主要地,CAR-T细胞通过T细胞表面的scFv识别TAA而被激活,随后激活由scFv连接的细胞内的信号域,诱导涉及T细胞增殖、激活和细胞因子产生的下游信号通路。科学家们做了很多努力来提高疗效和持久性以及减少T细胞衰竭。总的来说,异体和通用的CAR-T一代因其对患者的广泛和迅速的使用而备受关注。韩国首尔国立大学Dong Wook Kim and Je-Yoel Cho在Biomolecules上发表文章,综述了目前异体和通用型CAR-T细胞的生成技术及其存在的不足和有待克服的局限性。
起初,CAR-T疗法在血液系统癌症患者身上进行了试验,特别是对采用造血干细胞移植(HSCT)和化疗等已知疗法而无改善的B细胞急性淋巴细胞白血病(B-ALL)患者,CAR-T疗法是最后一种治疗方案。目前,两种CAR-T细胞药物YESCARTA(axicabatagene ciloleucel)和KYMRIAH(tisagenlecleucel)分别被FDA批准,用于某些对至少两种其他治疗后没有反应或复发的大B细胞淋巴瘤的成人患者,以及治疗年龄在25岁以下的B细胞前体患者,所有这些患者都是难治性的或是第二次或以后复发的。国际免疫遗传学信息系统®IMGT/mAb DB中中还引用了其他三个具有国际非专用名称(INN)的CAR-T,即vadacabtagene-Leraluecel、idecabtagene-Vicluecel和Liscabatagene-Maraluecel。
尽管CAR-T治疗过程中仍存在诸如细胞因子释放综合征(CRS)和神经毒性等副作用,但最近通过各种先进技术使用修饰的CAR-T细胞的研究显示了更有效和安全地使用CAR-T细胞的前景。CAR-T细胞的有效和安全使用可能包括以下几个概念:(1)在将CAR-T细胞注射回患者体内之前,应快速产生CAR-T细胞,以避免疾病的进一步发展。(2) CAR-T细胞既可用于同种异体,也可广泛应用。基因编辑是制造通用CAR-T细胞最广泛使用的技术。这个系统的一个主要靶点是T细胞受体(TR),以最大限度减少在异体移植过程中的移植物抗宿主病(GvHD)的发生。为了尽量减少GvHD,可以在异体治疗前进行化疗,包括Fludarabine 和 Cyclophosphamide的免疫抑制联合治疗,以及使用抗CD52单抗的血清治疗。当使用CAR-T细胞作为药物时,需要慎重考虑的另一点是对副作用的小心处理。由于CAR-T细胞的疗效主要来源于各种释放的细胞因子,因此常见的副作用往往与细胞因子的不可控释放有关,并且可能是非常有害的;例如,一些细胞因子可以穿透血脑屏障(BBB)并引起神经毒性。为了防止这个问题,人们开发了各种安全开关,如自杀基因的掺入,治疗性抗体的已知靶基因的表达,以及在CAR和肿瘤细胞之间添加分子开关蛋白等。
早期试验创建CAR-T细胞时,将VHsp6与Cα或Cβ融合,发现VHCα或VHCβ嵌合链可与受体T细胞的β或α链形成异二聚体。这是第一个摆脱MHC限制的T细胞活化方式的系统。随后通过添加CD247的信号域(第一代CAR)、添加TNFRSF9或CD28的一个共刺激域加上CD247域(第二代CAR)、添加CD28和TNFRSF9的两个共刺激域加上CD247域(第三代CAR)来设计CAR的信号域,添加一个共同刺激加上CD247结构域和IL12表达系统(第四代CAR),以及添加一个共同刺激,结合STAT3和CD247结构域的细胞因子受体的细胞内结构域(例如,IL2RB链片段)(第五代CAR)。所有CAR结构的修饰都是为了增强CAR-T细胞的活性,增加细胞的增殖和细胞因子的释放,减少T细胞的衰竭。从理论上讲,对CAR结构进行各种修改是可能的,但迄今为止使用的基本结构可能不会有明显改变。CAR结构中使用的各种信号域的一般功能和描述如下,并在图1中进行了总结。
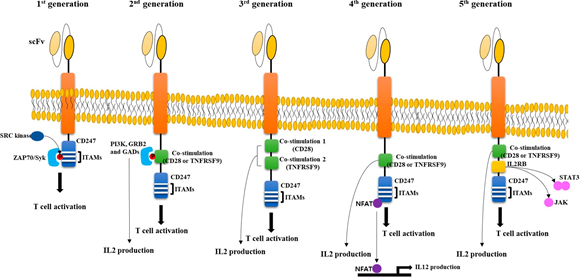
图1。CAR-T细胞的结构。CAR-T细胞由单链可变片段(scFv)、跨膜结构域和信号转导结构域组成。第一个CAR-T细胞只有cd247itam(免疫受体酪氨酸基激活基序)结构域,激活ZAP70/Syk酪氨酸激酶,激活下游信号级联。第二个CAR-T细胞有一个来自CD28或TNFRSF9的额外共刺激结构域。含有SH2结构域的各种蛋白质如PI3K、GRB2和GADs被招募到共刺激结构域并诱导产生IL2。在第3个CAR-T细胞中,包含两个共刺激域,从而对肿瘤细胞产生更多的细胞毒性活性。在第4个CAR-T细胞中,产生IL12的额外基因被导入CAR-T细胞。IL12的表达受NFAT转录因子控制,NFAT转录因子通过与CD247结构域结合而被激活。该系统是为了在CAR-T细胞由于表面抗原低表达而不能识别肿瘤细胞的情况下激活天然免疫系统而开发的。在第5代CAR-T细胞中,来源于IL2RB的JAK-STAT激活域被整合在CD28和CD247之间。该结构域刺激细胞增殖,阻止终末分化,并显示出更好的持久性。
CD247(称为CD3ζ)是TR-co受体的CD3复合物中的跨膜转接器。CD247有三个基于酪氨酸的免疫受体激活基序(ITAMs),实现T细胞激活。除T细胞激活外,CD247还参与Nkp46/Nkp30的信号传导,是NK细胞中IgG CD16的低亲和力Fc受体。在CAR-T构建中,ITAMs通常被整合到CAR结构中以诱导T细胞增殖和活化。ITAM在CAR-T细胞活化中的作用被鉴定为通过与细胞内天然CD247伙伴的异源二聚作用介导。此外,在CD247中的三种ITAM中,第三种ITAM已被确定不影响T细胞活化,但第二种ITAM被确定为T细胞活化的关键因素。
虽然第一代CAR-T细胞的成功试验显示了抗肿瘤活性,但由于T细胞的持久性较低,其疗效并不充分。为了克服这个问题,增加了一个共刺激域。TNFRSF9(称为4-1BB和CD137)是肿瘤坏死因子(TNF)受体家族的成员,已知在活化的T细胞中表达。通过比较具有和不具有靶向CD19的TNFRSF9信号结构域的CAR-T细胞,证明了共刺激结构域对抗肿瘤活性的重要性。与没有TNFRSF9结构域的CAR-T细胞相比,具有TNFRSF9结构域的CAR-T细胞对B-ALL显示出强大且特异的细胞毒性,并产生更多的IL12,这表明额外的信号结构域对于增强CAR-T细胞的活性是必需的。
CAR-T活性的另一个共刺激域来自CD28,被称为CD80的受体,在T细胞刺激时刺激各种白细胞介素的产生[19]。CD28胞内结构域中酪氨酸170处的磷酸化是其与含有SH2结构域的蛋白质(如PI3K、Grb2和Gads)结合的原因,导致IL2产生增加和T细胞活化[20–22]。对比分析不同的CAR结构以观察TNFRSF9或CD28共刺激结构域的效果,发现当与表达靶抗原的癌细胞共培养时,具有任一共刺激结构域的CAR-T细胞的扩增率高于单独具有CD247结构域的CAR-T细胞。此外,同时含有CD28和TNFRSF9结构域的CAR-T细胞与单独含有其中任一结构域的细胞的肿瘤溶解活性之间没有显著差异[23],从而导致单独使用CD28或TNFRSF9的第4代细胞。
添加一个共刺激结构域似乎足以使CAR-T充分发挥活性,但一些研究表明,可能需要另一个因素来增强CAR-T细胞的肿瘤杀伤作用。使用CAR-T细胞的一个关键问题是,只有当靶肿瘤细胞中的抗原暴露并被捕获时,它们才能被激活,这意味着一些无抗原的肿瘤细胞可能会从CAR-T细胞中逃逸出来。为了克服这个问题,我们开发了表达IL12的CAR-T细胞,并将其命名为T细胞,用于细胞因子介导的普遍杀伤(TRUCK)。其主要功能包括将原始T细胞分化为Th1细胞、激活自然杀伤细胞和T淋巴细胞以及抗血管生成活性。利用NFAT转录因子刺激IL12产生的第四代CAR-T系统已经在包括实体瘤在内的多种肿瘤上进行了测试,并显示出了有希望的结果。
最近,新开发的第五代CAR-T细胞被用来诱导细胞因子信号传导,其中IL2RB链片段插入TR信号传导(CD247)和共刺激域(CD28)之间。由于IL2RB片段具有STAT3结合YXXQ基序,这些CAR-T细胞诱导JAK-STAT通路的抗原依赖性激活,从而促进细胞增殖并阻止终末分化。此外,这种CAR-T细胞比单独含有TNFRSF9共刺激结构域的CAR-T细胞表现出更好的持久性和治疗白血病的效果。
尽管自体CAR-T细胞治疗造血系统肿瘤是安全有效的,但也存在一些局限性,如制备足量CAR-T细胞的时间过长。因此,异体治疗已经得到了强有力的测试,并在一些研究中显示了前景。由于自体CAR-T细胞治疗在临床试验中显示出显著的毒性问题,因此异体CAR-T细胞产生的毒性也被认为是显著的。尽管如此,异体CAR-T细胞疗法因其可获得的巨大优势已被应用于许多患者。CAR-T细胞的来源可以是自体或异体。异基因来源的CAR-T细胞见于异基因造血干细胞移植患者,可以是供体来源的,也可以是受体来源的。有研究表明,受体来源的CAR-T细胞治疗与自体CAR-T细胞治疗相比,CRS患者的完全缓解率(CR)增加。尽管受体来源的CAR-T细胞并非真正的同种异体,但本研究揭示了同种异体CAR-T细胞治疗复发/难治性ALL患者的潜在疗效。同时,在对ALL、NHL(B细胞非霍奇金淋巴瘤)和CLL(慢性淋巴细胞白血病)患者进行CAR-T细胞治疗后进行异基因造血干细胞移植,以评估移植后的毒性。在这项研究中,所有患者都接受了异基因造血干细胞移植,NHL/CLL患者接受了清髓预处理,但死亡率较高。
当异体CAR-T细胞治疗被应用时,GvHD总是与一个需要克服或最小化的问题相关。早期研究表明,B细胞相关疾病患者的供体来源的CAR-T疗法显示出非常低的GvHD水平,尽管存在低血压和发热等毒性问题。此外,一项调查供体来源的CD19 CAR-T细胞在异基因造血干细胞移植中的作用的小鼠研究表明,异体CAR-T细胞具有强大的移植物抗淋巴瘤活性,降低了GvHD,并确定了TNFRSF9共同刺激的CAR-T细胞增加了GvHD的发生,尽管TNFRSF9共同刺激已经被证实是有效的通过重复的CAR信号降低T细胞衰竭。此外,在一项针对ALL、NHL和CLL患者的研究中,报告了25%的急性或10%的慢性GvHD发生率。因此,同种异体CAR-T细胞治疗需要进一步的技术进步来克服GvHD。
避免GvHD是异基因CAR-T细胞治疗中需要克服的一个主要障碍,尤其是当应用于患者的CAR-T细胞是由HLA不匹配的健康供体产生时。
大多数移植物抗宿主病的发生是由于异体T细胞受体(TR)的多样化重现的结果。为了克服这个问题,利用各种技术在TR上开发了新的工程化CAR-T细胞。更有效的CAR-T细胞也可以通过破坏TR和β-2微球蛋白产生,这两种微球蛋白分别负责GvHD和宿主抗移植物效应(HvGE),以及破坏PDCD1(PD1)与CD274(PDL-1)的结合,从而提高CAR-T细胞治疗的有效性。最近,利用CRISPR/Cas9进行的无双链断裂诱导易位的T细胞高级复合工程被开发出来,并显示出工程化T细胞的扩增得到改善,与非预期的基因组改变和遗传毒性相关的安全风险降低。
另一种关闭由TR触发的信号通路的方法是用内质网保留信号转导CD247结合的单链可变片段跨膜结构域。这种在内质网中过度表达的CD247特异性单链抗体可以捕获CD247,从而抑制CD247与TR的相互作用,从而抑制TR信号转导。更先进的同种异体CAR-T细胞是通过增加安全选项而产生的。在这个系统中,过度激活的CAR-T细胞可以被识别CD20模拟表位并阻断激活信号的利妥昔单抗靶向,从而消除这些细胞。
抑制CAR-T疗法的异基因GvHD效应的另一种可能方法是使用抑制TR信号通路的药物进行治疗,如图2所示。最近,静脉注射免疫球蛋白(I5. VIg)被证实可以抑制TR介导的信号通路,IVIg通常用于治疗自身免疫和感染性疾病。溶血磷脂酸(LPA5)G蛋白偶联受体(GPCR)被鉴定为在CD8 T细胞中表达,并与慢性炎症疾病中通常增加的溶血磷脂酸生物活性血清脂质结合,从而抑制早期TR信号,包括钙动员和ERK激活。
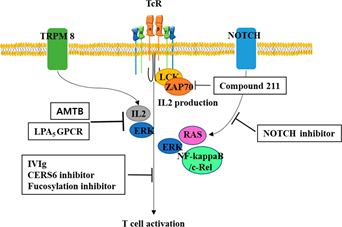
图2。T细胞活化的潜在抑制剂。为了减少GvHD,T细胞活化抑制剂可能有用。静脉注射免疫球蛋白(IVIg)、神经酰胺合成酶6(CERS6)抑制剂、岩藻糖基化抑制剂可抑制T细胞活化,可用于改善CAR-T细胞治疗中的GvHD。另一种潜在的抑制剂可能是N-(3-氨基丙基)-2-[(3-甲基苯基)甲氧基]-N-(2-噻吩甲基)-苯甲酰胺盐酸盐(AMTB)和溶血磷脂酸G蛋白偶联受体(LPA5-GPCR),它们已知抑制钙介导的T细胞活化。化合物211为变构非竞争性选择性CD45酪氨酸磷酸酶抑制剂,可抑制TR介导的LCK、ZAP70、ERK和IL2的表达和激活。Notch信号抑制剂可通过降低RAS(H-、K-、N-)、ERK和NF-κb的活性来降低T细胞的活化。
在一项研究GvHD发展与CERS6活化之间关系的试验中,将CERS6的特异性抑制剂应用于小鼠和人类T细胞,并显示T细胞活化显著降低,表明CERS6抑制剂可能是控制GvHD的一种有希望的试剂。此外,小分子c-Rel抑制剂通过削弱IL2产生的负反馈,显示出T细胞的同种异体活化减少,而不影响抗肿瘤活性。Notch抑制也显示了在CD4+或CD8+T细胞中诱导的抗GvHD作用,并且在通过TR再刺激时显示RAS/ERK和NF-kappaB活性降。
总的来说,通过基因工程,主要通过TR失活和TR信号介导的特异性抑制剂来减少GvHD的各种试验已经进行。降低CAR-T细胞的异基因GvHD效应固然重要,但在应用于患者之前,需要仔细验证CAR-T细胞是否能通过基因工程或抑制剂介导毒性。
通过在CAR-T细胞和肿瘤细胞之间添加开关分子,可以实现异基因CAR-T细胞的更强大和更广泛的应用,称之为通用异体CAR-T细胞(UniCAR-T)。特异性开关分子负责将CAR-T细胞的CAR结构与肿瘤细胞中识别TAAs的抗体连接起来,从而实现CAR-T细胞对各种肿瘤细胞进行靶向。开关分子可以通过蛋白质-蛋白质相互作用或蛋白质-化学相互作用产生,其中每个部分应连接到抗体或CAR。因此,UniCAR-T系统具有通过改变待注射的开关分子-抗体复合物的数量来控制CAR-T细胞活性的巨大优势。
以TAAs为靶点的各种抗体可以很容易地通过化学或遗传方式与分子适配器相连。例如,开发了一种基于抗体的双功能开关,该开关由连接到靶向TAA的肿瘤抗原特异性Fab区域的肽neo表位(PNE)构成,并且可以与连接到CAR的抗PNE单链抗体结合。这种开关模型允许以剂量依赖的方式控制CAR-T细胞的活性、组织归巢、细胞因子释放和表型。另一种类型的开关分子是FITC-叶酸系统。
此外,还创建了FITC-HM-3双功能分子(FHBM)作为开关分子,用于新型可转换双受体CAR工程T细胞。创建了两个CAR,每个CAR都有能力分别绑定到FHBM的TAA或FITC。因为每一个CAR都有一个CD247和TNFRSF9结构域作为细胞内的信号诱导物,所以这两个CAR都应该被激活。因此,一个CAR应与TAA结合,另一个CAR应与FHBM的FITC结合以激活CAR-T细胞。这种带有开关分子的双激活系统可以有效地控制CAR-T细胞的活性。
另一个开关分子是亮氨酸拉链结构域,它是广泛参与蛋白质相互作用的内源性核-分子相互作用结构域。SUPRA(split,universal,and programmable)CAR系统利用亮氨酸拉链结构域作为开关分子。
单体链霉亲和素2(mSA2)生物素结合域也被引入作为开关分子。识别TAA的生物素化抗体可以被与CAR结构相连的mSA2结构域的CAR-T细胞捕获。本文中描述的开关分子如图3所示。
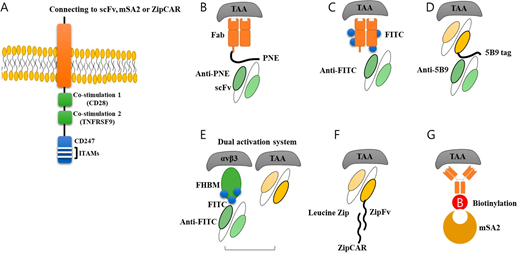
图3。各种开关分子。为了普遍使用CAR-T细胞,人们开发了各种开关分子。(A) 一般的CAR结构由细胞内信号域、跨膜域和细胞外单链抗体组成。单链抗体部分可以通过加入开关分子进一步修饰。(B) 肽新表位(PNE),(C)荧光素(FITC),(D)10个氨基酸(5B9标签),(E)FITC-HM-3双功能分子(FHBM)和单链抗体,(F)亮氨酸ZipFv与抗体连接,以及(G)链霉亲和素2(mSA2)生物素结合域被开发用作开关分子。这些分子可以被抗体或与CAR相连的ZipCAR识别,从而诱导和激活CAR-T细胞的信号通路。该系统通过改变与抗体连接的开关分子的数量来控制CAR-T细胞的活性,具有很大的优势。
在发育过程中,应选择开关分子,使其不会诱导额外的免疫原性反应,如移植物抗宿主病,其特异性应确保最小的反应性。
尽管CAR-T治疗的有效性已经提高,但在应用于患者时仍然可以观察到神经毒性和CRS等副作用。安全开关之一是使用一种激酶抑制剂来阻断TR介导的信号通路。Dasatinib是一种众所周知的淋巴细胞特异性蛋白酪氨酸激酶(LCK)抑制剂,它可以阻断LCK介导的CD247的磷酸化,从而阻断由含有CD28+CD247或CD247的CARs介导的信号通路TNFRSF9加上CD247激活域。另一种安全激活CAR-T细胞的方法是使用自杀基因诱导系统。rimiducid诱导的MyD88和CD40活化可消除过度活化的CAR-T细胞。
利妥昔单抗已被用于治疗许多癌症,如非霍奇金淋巴瘤、类风湿性关节炎和慢性淋巴细胞白血病,通过产生过度表达CD20的CAR-T细胞,利妥昔单抗治疗可作为CAR-T细胞过度激活时的安全试剂。这是一种非常快速的控制方法,可减少细胞因子的释放,甚至可导致CAR-T细胞死亡。表皮生长因子受体(EGFRt)的截短型在cd19car-T细胞中也表达为一种安全的自杀基因,可被西妥昔单抗靶向。西妥昔单抗治疗显示,在小鼠过继转移后早期和晚期,CD19 CAR-T细胞均被有效清除。调节CAR-T细胞活性的各种安全系统仍在开发中,但预测潜在的副作用是很重要的,在完全应用于患者之前应该进行测试。
CAR-T细胞疗法被称为一种活的药物,用于治疗其它疗法(如HSCT和化疗)无改善的B-ALL患者,近十年来得到了广泛的应用,并显示出良好的效果。然而,
YESCARTA
和KYMRIAH是FDA批准的唯一用于治疗成人患者的CAR-T细胞,这是在所有其他治疗之后的最后手段。自体CAR-T细胞治疗在缩短患者再注射时间方面仍有许多障碍需要克服。对于那些不易获得自体T细胞和低成本通用CAR-T细胞的患者来说,开发同种异体通用CAR-T疗法是一个迫切的需求。在CAR-T治疗方案中,通过增加安全系统来减少GvHD是必要的。为了解决这些问题,人们取得了许多技术进步,如基因编辑。此外,最近的研究集中于CAR-T细胞在实体瘤中的应用,证明了CAR-T细胞疗法的广泛应用,并在不久的将来为其在代谢、心脏和罕见疾病等其他疾病中的应用开辟了可能性。
六大板块聚焦行业热点
行业大咖纵论产业前沿
千人汇聚共襄科技盛举
时间:2021年6月19-20日
地点:上海(具体地点报名后通知)
规模:800人
主办单位:四叶草会展
支持单位:生物制品圈、陆道培医疗集团
会议费用:为生物医药技术研发人员提供参会福利,5月20日之前报名FREE!(仅收取100元定金,含茶歇、会议资料等,定金概不退还),先到先得,报完即止,5月20日以后报名将收取会议费!
报名方式:扫描下方二维码或点击文章最底部“阅读原文”→ 填写表格 → 报名成功!

如需赞助,扫码登记即可!
组委会获得报名信息后,根据报名信息进行初筛,并进一步与报名者沟通确认,实现精准邀请。最终有机会进入大会微信群(严格审核通过)。

识别微信二维码,添加生物制品圈小编,符合条件者即可加入生物制品微信群!

本公众号所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系(cbplib@163.com),我们将立即进行删除处理。所有文章仅代表作者观点,不代表本站立场。
















 个人中心
个人中心
 我是园区
我是园区





