责编 | 兮
尽管大量临床数据显示转移(Metastasis)是肿瘤致死的主要因素,但其内在的分子机制尚不清晰,同时也导致了干预手段的匮乏。目前的研究结果表明,肿瘤转移是一个漫长而复杂的过程,从原位肿瘤侵润周边组织,到突破血管内皮进入循环系统,再到出血管在远端器官形成转移灶。在这一过程中,每一个扩散的肿瘤细胞需要不断的与不同的组织微环境交互作用,通过不断的调整基因表达模式和能量代谢途径来获得更好的生存空间。这其中,肿瘤细胞必须获得大量的能量来驱动迁移和侵润,在循环系统中需要克服由于失去与其他细胞相互作用而引起的细胞凋亡以及血流剪切力造成的细胞损伤,在远端组织需要对抗不同与原位灶的营养环境以及高氧化损伤引起的细胞死亡,同时需要规避在整个过程中所遭受的免疫细胞的攻击,据估计只有少于0.02%的扩散的肿瘤细胞最后能够成功的在远端组织形成转移灶。因此,系统了解扩散细胞如何改变其自身代谢模式以适应远端组织的营养环境和氧化损伤对于进一步预防和治疗肿瘤转移具有积极意义。
肿瘤代谢重编程(Metabolic Reprogramming)在肿瘤发生发展及转移中的作用不断被揭示。传统的观念认为,肿瘤细胞会更依赖于糖酵解(Glycolysis)途径而不是三羧酸循环来更快的获取能量已实现高速增殖,这也被称为Warburg效应, 而三酸酸循环的作用往往被忽视。然而通过同位素标记的代谢追踪实验表明在很多肿瘤细胞中三羧酸循环具有同等重要的功能。另一些证据表明通过增加线粒体合成来增强三羧酸循环可以促进肿瘤转移。因此,三羧酸循环对于肿瘤的意义尤其是在肿瘤转移中的作用需要获得重新的审视。
2020年10月5日,美国Wake Forest大学林慧观教授团队(第一作者为蔡震博士)在Molecular Cell上发表文章Phosphorylation of PDHA by AMPK drives TCA cycle to promote cancer metastasis,首次揭示了丙酮酸脱氢酶活性的新型调控模式及其在三羧酸循环和肿瘤转移中的重要意义。

线粒体作为三羧酸循环发生的主要场所,其数量极大的决定了三羧酸循环的水平。AMPK作为重要的能量相应分子,能够同时调控线粒体生成和线粒体自噬(Mitophage)过程。长期以来AMPK一直被认为具有抑制肿瘤的功能,很大程度上由于很多抑制肿瘤的药物能够激活AMPK。而令人吃惊的是,林教授的团队通过分析大量的临床数据发现AMPK的高表达与乳腺癌的转移高度相关。为进一步证实该结果,研究人员建立了能形成自发转移的乳腺癌小鼠模型并发现相对于原位肿瘤,转移灶中AMPK的活性明显增高。同时,在干扰AMPK表达后对原位肿瘤的生长没有明显影响,但能够显著降低乳腺癌的肺转移发生,并对葡萄糖缺乏引起的代谢压力和高氧化损伤更为敏感。这一结果表明AMPK是一个重要的肿瘤转移调节因子,很可能通过调节肿瘤细胞的代谢模式使其能够更好的适应远端组织的微环境,以对抗不同于原位灶的营养环境以及高氧化损伤引起的细胞死亡来促进肿瘤转移。
相较于糖酵解主要依赖葡萄糖进行产能,三羧酸循环能够在氧气充足的条件下利用更为广泛的营养来源包括丙酮酸,谷氨酰胺,天冬氨酸等多种氨基酸以及多种脂类降解产生的乙酰辅酶A(Ac-CoA)来进行产能,同时很多三羧酸循环产物诸如α-酮戊二酸,草酰乙酸具有对抗氧化压力的功能,因此,三羧酸循环的强化很有可能对于肿瘤细胞转移尤其是肺转移具有积极意义。该团队也进一步证实了在AMPK低表达或缺失的细胞中,三羧酸循环以及氧化磷酸化的水平明显降低,而同位素标记的丙酮酸示踪实验也表明在AMPK缺乏的细胞中,丙酮酸代谢进入三羧酸循环的能力明显降低。
通过一系列的机制探讨,研究人员最终将目标锁定在了三羧酸循环关键的限速酶丙酮酸脱氢酶复合体上。在AMPK缺失的细胞中,该酶的活性明显降低。在细胞中,干扰丙酮酸脱氢酶催化亚基(PDHA)从而破坏其功能能够模拟AMPK缺失所引起的相关形状包括肿瘤转移能力下降和对葡萄糖缺乏引起的代谢压力的不耐受,而将持续活化的PDHA导入AMPK缺失的细胞中能够极大地回复相关的表型,包括肿瘤转移能力以及重新获得对代谢压力和氧化损伤的耐受。
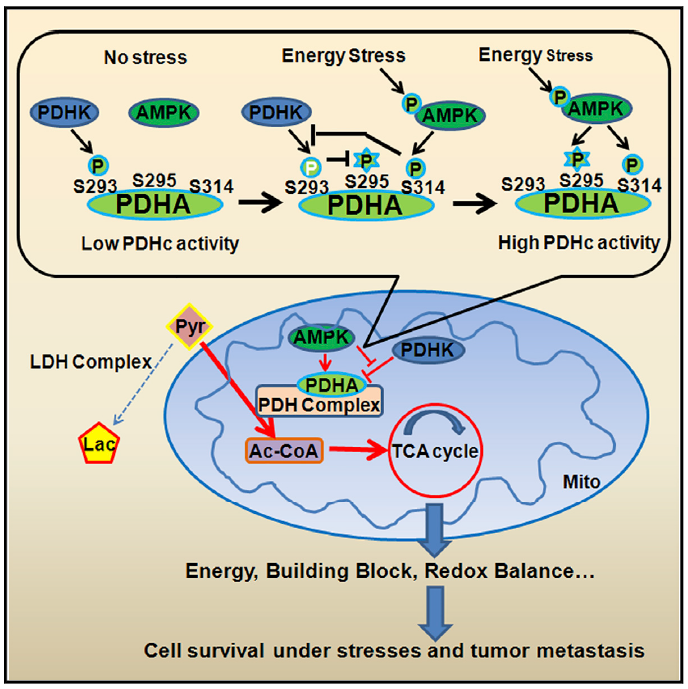
以往的研究发现,丙酮酸脱氢酶复合体的活性与其催化亚基PDHA上293位丝氨酸亚基(S293)的磷酸化水平呈负相关性。在本项工作中,研究人员发现AMPK的活化能够有效地阻断上游激酶PDHKs和PDHA的结合并降低PDHA S293的磷酸化水平从而维持丙酮酸脱氢酶在高活性状态。这一结果同样在乳腺癌临床标本中获得了很好的体现,AMPK(T172)磷酸化水平和PDHA(S293)磷酸化水平呈现显著负相关,而高AMPK(T172)磷酸化水平和低PDHA(S293)磷酸化水平预示较差的无转移生存期(Metastasis-free survival)。
为了进一步探索作为激酶的AMPK是否能够直接磷酸化PDHA,研究人员分离了线粒体的各组分,首次发现AMPK能够定位于线粒体的基质(Mitochondrial Matrix)并与PDHA相结合。体外激酶实验,P32ATP参入实验和质谱分析显示AMPK可以诱导PDHA 295和314位丝氨酸亚基(S295和S314)的磷酸化。随后研究人员构建了特异性针对PDHA S295和PDHA S314磷酸化的抗体并在体内证实AMPK的活化能够有效地诱导PDHA S295位点和PDHA S314位点磷酸化。而将这两个位点持续磷酸化的突变体(PDHA S295D和S314D)导入AMPK缺乏的细胞中能够显著改善三羧酸循环水平以及肿瘤肺转移。更令人吃惊的是,PDHA S295D和S314D knock-in细胞能够显著增强肿瘤的远端转移能力。随后的机制研究发现,作为一个先导的磷酸化位点,PDHA S314位点的磷酸化能够有效地阻断PDHKs和PDHA的结合并导致S293位点磷酸化水平降低。由于空间位阻的关系,低水平的S293磷酸化能够提供足够的空间使得AMPK能够进一步磷酸化其相邻的位点S295。而S295位点的磷酸化做为一个固有的催化位点,对于丙酮酸脱氢酶将丙酮酸转换成为乙酰辅酶A必不可少,S295位点的低磷酸化将直接导致丙酮酸滞留于丙酮酸脱氢酶复合体中而无法被分解。
总之,这项研究首次详细阐明了AMPK通过调节丙酮酸脱氢酶复合体的活性从而调控三羧酸循环水平,以帮助扩散的肿瘤细胞能够更好的适应远端组织的微环境从而促进其转移。为进一步重新审视三羧酸循环在肿瘤转移过程中的重要作用提供了实验依据。从临床角度,这项研究指出AMPK以及PDHA活性的高低可以作为一个重要而有效的指标来推测乳腺癌病人肺转移状况,同时表明针对AMPK或者丙酮酸脱氢酶所开发的药物可能对于乳腺癌的肺转移具有抑制作用。而在机制方面,这项研究首次发现AMPK可以定位于线粒体基质中并提出了一个针对PDHA活化的连续磷酸化模型,发现了两个由AMPK所介导PDHA的新的功能性磷酸化位点S295和S314。
据悉,该文章的第一作者为蔡震博士,蔡震博士现为美国Wake Forest大学医学院助理教授,通讯作者为林慧观教授。
原文链接:
https://doi.org/10.1016/j.molcel.2020.09.018
制版人:琪酱




 个人中心
个人中心
 我是园区
我是园区




