近日,南方科技大学王培毅团队与牛津大学Peijun Zhang团队合作从临床患者体内分离新冠病毒,通过β-丙醇酸内酯灭活病毒,利用冷冻电镜和冷冻电子断层扫描技术解析了完整SARS-CoV-2颗粒上的刺突蛋白结构,为理解生理条件下膜融合前后刺突蛋白的构象提供了更加精确的信息,研究成果发表在Cell子刊Structure期刊上。

标题
新冠病毒的刺突蛋白是入侵细胞和抗体中和的重要结构。刺突(S)蛋白通常呈三聚体结构,每个单体包含受体结合相关的S1亚基、病毒融合相关的S2亚基。刺突蛋白上有两类酶切位点,在刺突蛋白从内质网运输到高尔基体时会被细胞内蛋白酶切割并组装为成熟的病毒粒子;在病毒入侵细胞时刺突蛋白又会被蛋白酶TMPRSS2激活促进膜融合。其中刺突蛋白构象变化如何导致膜融合还缺乏深入的研究。研究者首先从深圳第三人民医院COVID-19患者中鉴定了新冠病毒的基因序列,在BSL-3实验室开展了Vero细胞病毒扩增和分离的工作,病毒能够结合患者血清及人单克隆抗体,ELISA实验显示具有高亲和力。
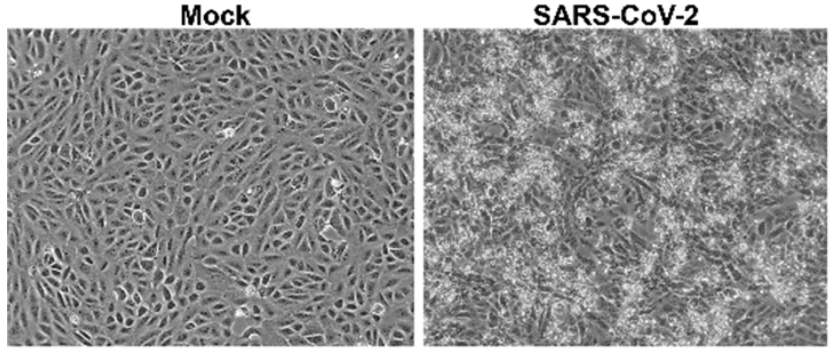
新冠病毒感染细胞病变
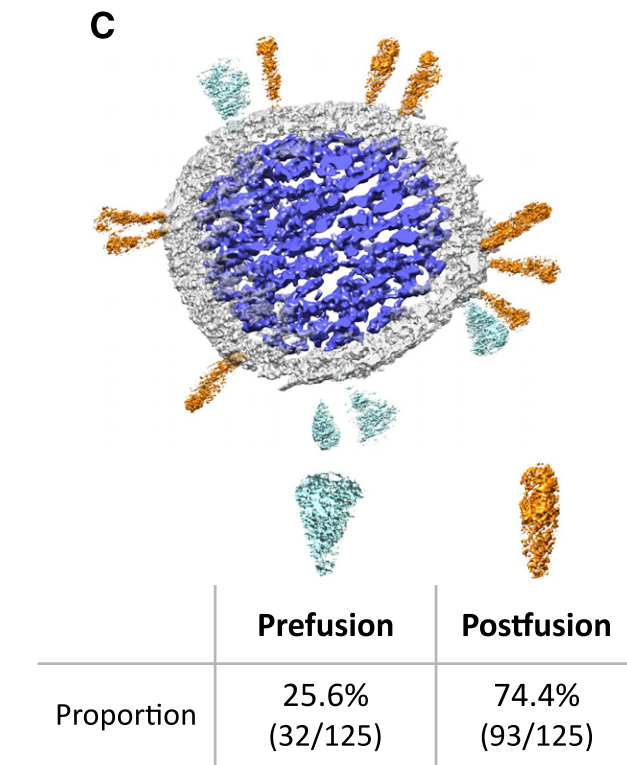
利用β-丙醇酸内酯对临床毒株灭活,通过电镜复染、冷冻电镜及断层扫描依次观察。可以观察到病毒整体呈球形或多面体,不同颗粒刺突蛋白分布不均,表面存在两类刺突蛋白,较大的是完整的S蛋白三聚体,而较细尖的是膜融合后的S2三聚体。断层扫描清晰显示了刺突蛋白成簇排列,融合前刺突蛋白与膜融合后的S2蛋白构象基本一致,且融合后刺突蛋白为主。同时可以观察到病毒内部核蛋白复合体规则排列。

电镜下病毒完整结构
利用亚断层扫描、平均化的算法近原子分辨率研究者解析了刺突蛋白特征性的融合后构象。刺突蛋白全长约240A,最宽处可达66A,其连接处和核心区最狭窄,仅27A,这与SARS病毒刺突蛋白在结构上高度相似。同时在刺突蛋白上的突起与糖基化位点相吻合。脂双层膜分辨率较低,这主要是由于膜融合过程中动态变化所致。
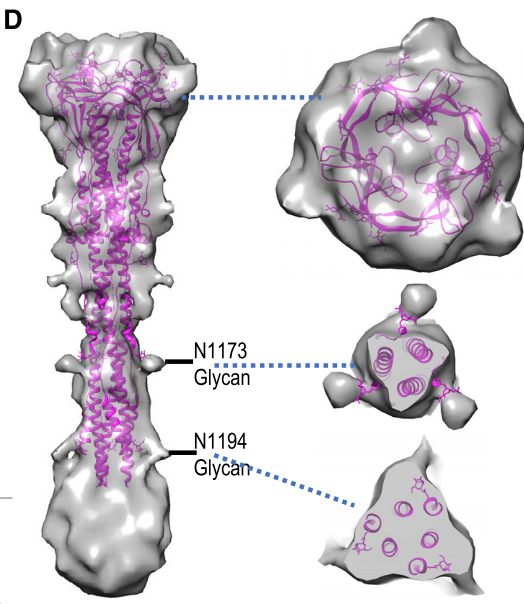
断层扫描刺突蛋白结构
该研究得到了深圳市第三人民医院医学支持以及南方科技大学的BSL-3实验室和冷冻电镜设备平台的支撑,同时也获得了牛津大学的技术帮助。项目在深圳市科技创新委员会、NIH、英国Wellcome Trust资助下开展。该研究解析了灭活新冠病毒刺突蛋白的真实结构,包括膜融合构象与糖基化位点。灭活疫苗的制备过程中,化学试剂的选取及灭活病毒的结构测定对于诱导抗体、避免ADE(抗体依赖增强作用)效应都是至关重要的,新冠病毒刺突蛋白的结构解析对于理解及改善灭活疫苗作用都将起到巨大帮助。
识别微信二维码,添加生物制品圈小编,符合条件者即可加入生物制品微信群!
请注明:姓名+研究方向!


本公众号所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系(cbplib@163.com),我们将立即进行删除处理。所有文章仅代表作者观点,不代表本站立场。




 个人中心
个人中心
 我是园区
我是园区




