亚洲胸部肿瘤研究组专家关于NSCLC MET变异的共识声明:检测和治疗注意事项
收藏
关键词:
肿瘤关于注意治疗瘤
资讯来源:基因谷 + 订阅账号
发布时间:
2022-09-07

非小细胞肺癌(NSCLC)是一种异质性疾病,有许多致癌驱动基因突变,包括MET基因突变(尤其是外显子14[ex14])。在EGFR突变的NSCLC患者中,获得性MET基因变异,特别是MET扩增,还与EGFR-TKI耐药的发生有关。虽然随着MET特异性抑制剂在某些地区的可及,MET已成为一种可靶向的生物标志物,但在亚太地区,对诊断平台和靶向治疗的可及性存在差异。
亚洲胸部肿瘤学研究小组(ATORG)小组达成了共识建议,以解决NSCLC MET变异检测和使用相关疗法的标准化方案中未满足的需求。对于携带MET ex14跳突的晚期转移性NSCLC患者,可以考虑使用MET抑制剂作为一线或二线或后线治疗;在用于检测NSCLC可靶向驱动突变的多基因panel中,首选MET ex14检测。鼓励EGFR突变且MET扩增导致EGFR TKI耐药的NSCLC患者入组EGFR TKIs和MET抑制剂的联合试验。
ATORG是由来自澳大利亚、香港、日本、韩国、中国大陆、马来西亚、菲律宾、新加坡、台湾、泰国和越南的专家组成的跨学科专家组。在2022年1月的一次共识会议上以及随后的线下协商中,ATORG小组讨论了MET变异的检测以及使用MET特异性抑制剂的注意事项。
MET是一种酪氨酸激酶受体,对细胞增殖和生长,以及肿瘤的运动和侵袭都至关重要。MET基因的ex14起着关键的调节功能,并通过该受体控制细胞信号传导。ex14功能的异常(
ex14内部的变异、周围内含子区域的变异或整个基因缺失
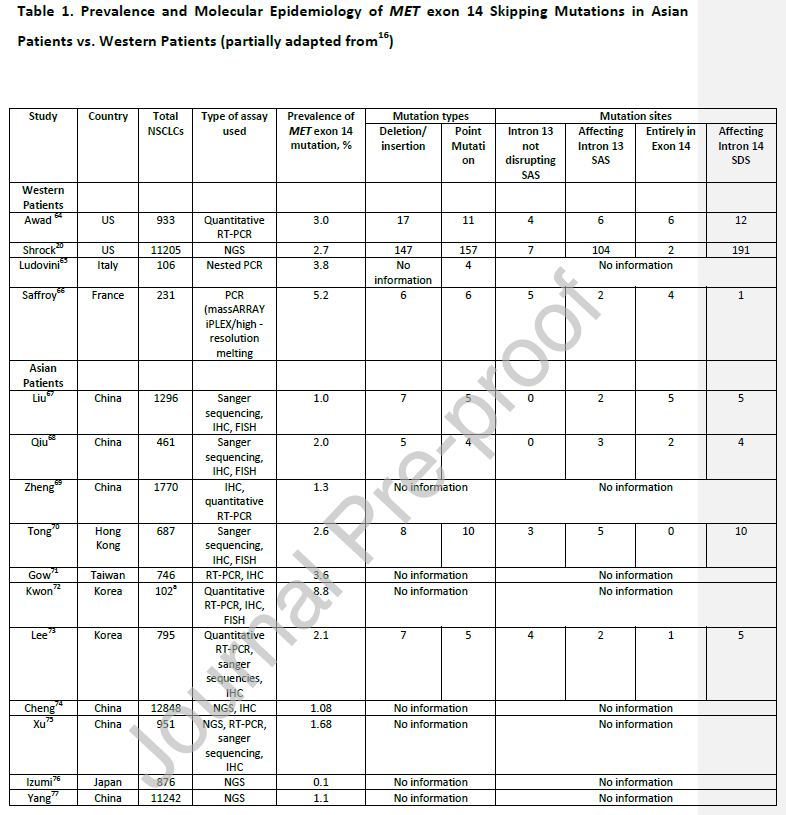
)导致构成性MET信号传导,造成细胞增殖和肿瘤生长。MET ex14突变的发生率在西方患者(
3%
)中略高于亚洲患者(
2%
)(
表1
)。MET ex14突变NSCLC患者通常年龄较大(
中位年龄65-76岁
),多为女性,很少有吸烟史,常伴有MET蛋白(
c-MET
)过表达,但没有其他致癌驱动因素。MET ex14突变在肉瘤样癌和腺鳞癌中的患病率较高。
MET扩增表示MET基因的基因拷贝数(
GCN
)增加,拷贝数5是常用的阈值。在1-5%的NSCLCs中,包括EGFR突变的NSCLC患者,可观察到MET扩增。MET扩增也可能发生在EGFR或其他TKIs耐药机制的背景下,在接受第三代EGFR TKI(
奥希替尼
)治疗期间,多达15%的疾病进展患者携带MET扩增。
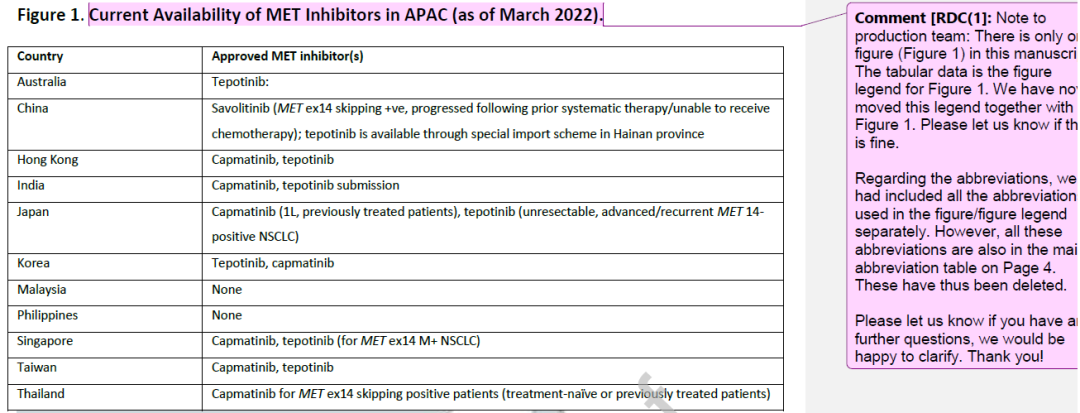
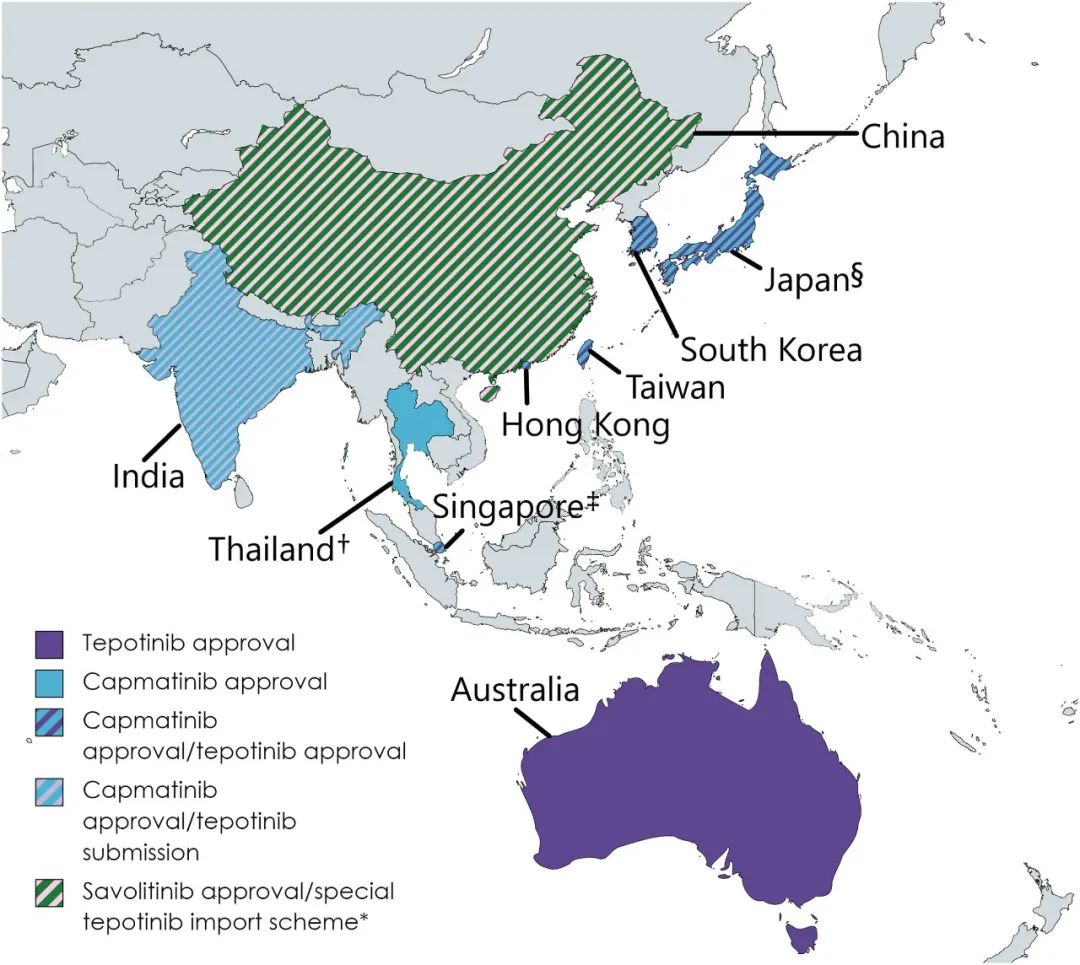
随着MET特异性抑制剂特泊替尼和卡马替尼在北美、南美、欧洲和亚洲特定国家的可及,以及赛沃替尼在中国的可及,目前,MET是一个可靶向的NSCLC生物标志物(
图1
)。然而,在亚洲,专家组认识到,由于MET变异的非标准化检测和选择性MET抑制剂的可及性差异,限制了这种靶向治疗在常规临床实践中的应运。因此,ATORG小组制定了共识声明来强调MET检测的重要性,就亚太地区标准化诊断工具的可及性和可负担性提出潜在的解决方案,并根据MET驱动的非小细胞肺癌的合适治疗方案提供临床建议。
Q1:检测MET ex14跳跃突变的最佳方法是什么?
检测MET ex14跳变的方法多种多样(
表2
)。来自组织活检的DNA通常用于检测MET变异;
由于许多不同的突变可导致MET ex14跳突,下一代测序(NGS)比单基因法更可取。此外,NGS还可以检测到其他致癌驱动因子。
在可用的商业检测方法中,基于杂交捕获技术的检测方法通常比非标准化基于扩增的方法更好。然而,最近的一些研究显示,基于DNA的检测方法不是检测MET ex14跳跃突变的充分检测方法,因为不同基因位点的突变具有多样性(
这可能会导致不正确的引物或探针结合
),或因为特定的NGS技术引入的伪影。
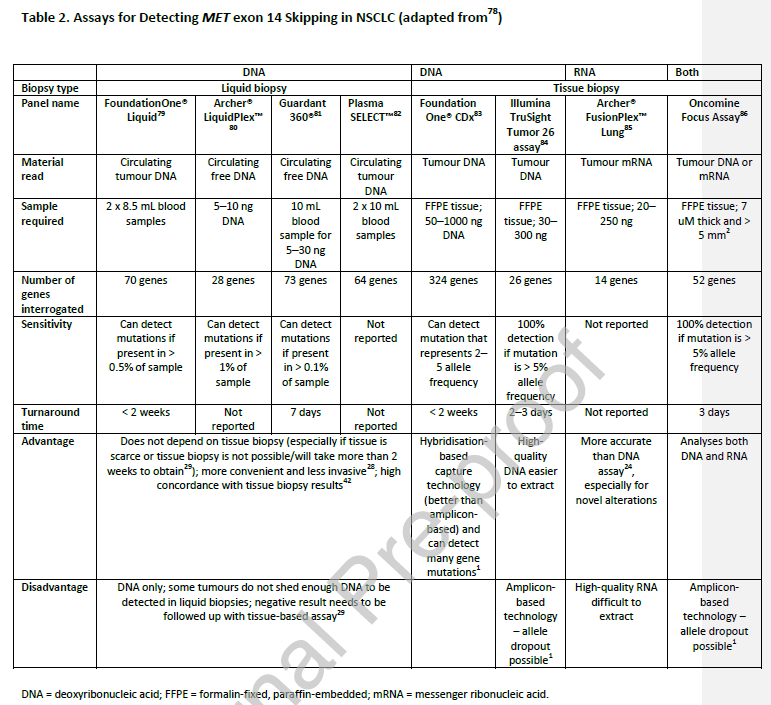
研究已发现,基于RNA的检测方法比基于DNA的更准确,并且检测缩短的RNA产物通常更容易。然而,从组织活检中提取高质量的RNA在技术上具有挑战性,因此,基于RNA的方法可以用于补充基于DNA的检测(
RT-PCR/NGS
),特别是在存在非典型变异的情况下。小的定制panel与大的NGS panel在性能上的差异尚未确定。
此外,当活检样本稀缺或无法获得时,分析液体活检 [血浆中的循环肿瘤细胞或循环肿瘤DNA (ctDNA)] 中的MET变异可以作为辅助工具。
液体活检方便且无创,但国际肺癌研究协会(
IASLC
)目前的建议指出,ctDNA检测结果为阴性的仍需进行确认性组织活检,因为某些患者的肿瘤负荷可能太低,无法在血浆中检测到MET变异。ctDNA检测作为研究工具仍在发展中且非常灵敏,但目前市面上还没有ctRNA的检测方法。液体活检也可用于预测治疗疗效。例如,在VISION II期试验中,特泊替尼用于MET ex14跳跃突变晚期或转移性NSCLC患者,在未经治疗和经治患者中,使用组织或液体活检分析观察到了一致的结果。
MET ex14跳跃突变导致受体降解受损,必然导致MET过表达。因此,MET免疫组化(
IHC
)是一种很好的筛选方法。然而,美国一家大型癌症中心最近的一项研究表明,免疫组化是一种检测这些变异的低效工具。该研究中几乎所有MET IHC阳性病例的MET ex14跳跃突变或MET扩增均为阴性。
综上,基于RNA的NGS检测是最准确的,但对组织活检中提取的DNA进行分析对于检测NSCLC中MET ex14跳突可能更实用和更易获得。此外,液体活检(
血浆中ctDNA
)分析越来越多地被采用,特别是当组织样本不足或无法获得时,因为液体活检分析更方便、侵入程度更低。由于目前可用的检测方法局限,根据患者的情况、不同检测方案的可用性和成本,进行正交检测(
orthogonal tests
)可能是有用的,可减少MET ex14检测假阳性或假阴性的可能性,从而避免对这些晚期NSCLC患者进行无效治疗。
ATORG共识:建议对晚期NSCLC患者进行MET ex14跳突检测。由于各种平台和技术的不断发展,以及在各自临床环境中关于组织可获得和检测可及性的实际考虑,没有规定最佳的检测方法。检测方法的选择应该基于检测可及性、检测特征和患者人口统计数据(即阳性的可能性)、疾病状况以及可获得的治疗方案。在用于检测NSCLC可靶向驱动突变的多基因panel中,首选MET ex14检测。根据病人的情况进行正交检测可能是有用的。
MET基因拷贝数的增加可以通过多倍体(
染色体复制
)和扩增(
局部或区域基因复制
)两种方式发生,多倍体不是致癌驱动因子,但扩增是EGFR TKIs耐药的重要机制。
荧光原位杂交(
FISH
)是检测MET扩增的常用方法,技术难度低于NGS,可用于区分多倍体和扩增(
7号染色体上MET与着丝粒蛋白的比值[MET/CEP7]在多倍体中不改变,但在局部扩增中观察到变化
)。在正在进行的临床试验中,通常将MET扩增的阈值设定为MET GCN≥5或MET/CEP7≥2.2。然而,扩增的阈值可能因试验的不同而不同,且从MET抑制剂获益的阈值没有明确定义,临床试验和临床社区也还没有采用单一标准的FISH检测。
多基因NGS panels在检测MET扩增方面越来越受欢迎。然而,这些平台的局限性在于数据质量高度依赖于所使用的平台,低拷贝数增加(
特别是当肿瘤细胞数量低时
)可能无法检测到。尽管有几项研究采用MET GCN阈值为>3-5倍,但MET扩增的阈值也不统一。与肿瘤突变负荷检测类似,这些检测需要标准化。
目前还不完全清楚FISH和NGS检测MET扩增的一致性如何,特别是在低水平扩增方面。一项研究使用MSK-IMPACT检测方法,一种基于NGS杂交捕获的方法,检测410个肿瘤相关基因的编码区,结果显示IHC/FISH与NGS具有较好的一致性。然而,最近的一项研究显示NGS和FISH之间的一致性较差。另一项研究显示,FISH与NGS的一致性仅为62.5%(
25/40
),NGS检测的MET扩增未能区分显著的临床疗效。
使用IHC分析MET蛋白过表达也通常被用作MET失调的生物标志物,因为它更便宜、更容易操作,特别是在临床试验患者的纳入筛选时。IHC评分2+或3+通常指示MET扩增。半定量的H评分还用于显示无、弱、中、强染色的癌细胞百分比,并计算为染色百分比乘以四个强度级别对应的序数值(
0=无、1=弱、2=中、3=强
)之和,结果评分范围从0(
肿瘤无染色
)到300(
肿瘤弥漫性强染色
)。最近,在埃万妥单抗(
一种EGFR/c-MET双特异性抗体
)和拉泽替尼(
第三代EGFR TKI
)的联合试验中,一种通过IHC检测并使用联合EGFR+MET H评分(
H评分>400指示EGFR/MET过表达
)的新方法被证明可以预测治疗反应,但这一生物标志物仍需进一步验证。免疫组化检测在检测MET扩增方面是不准确的,因此FISH和NGS仍然是首选的检测方法。
最近,液体活检被用于检测MET扩增,与在MET ex14检测中具有相同的局限性。但当组织活检无法获得时,液体活检可能是一种替代方法。例如,INSIGHT 2研究(
特泊替尼联合奥希替尼
)纳入了通过FISH或基于液体活检的NGS平台检测到MET扩增的患者。在
CHRYSALIS研究中,ctDNA(
血浆样本
)或肿瘤活检样本的NGS检测分别用于识别EGFR/MET突变和扩增,但也对IHC检测的EGFR/MET表达作为潜在的生物标志物进行了探索。
ATORG共识:目前检测MET扩增的金标准是FISH。然而,新技术正在不断发展和变得越来越可及,例如使用NGS检测组织活检或血浆样本中ctDNA(液体活检)的MET GCN。
Q3:目前可及的MET抑制剂有哪些?哪些区别特征决定治疗方案?
最近,在某些亚洲国家,有3种MET特异性抑制剂被批准用于MET ex14跳突转移性NSCLC患者,包括特泊替尼、卡马替尼和赛沃替尼。
特泊替尼是一种口服、选择性小分子MET激酶抑制剂,每日1次(
QD
)。特泊替尼在美国、加拿大、阿根廷、巴西、欧盟、英国、瑞士和以色列被批准使用;在亚太地区,它被批准在日本,韩国,香港,澳大利亚,新加坡和台湾,以及海南。
VISION试验(
NCT02864992
)是一项前瞻性、非随机、开放标签的II期临床试验,研究特泊替尼用于MET ex14跳突或MET扩增的晚期转移性NSCLC患者。该研究显示,特泊替尼在MET ex14跳突的患者中表现出良好的临床活性,与经治患者相比,未经治疗患者的中位持续反应时间(
mDoR
)更长(
32.7个月vs 10.1个月,进行组织活检评估的患者
),且具有可耐受的安全性(
表3
)。对亚洲特定人群的研究结果也显示了类似的结果,在一线治疗的患者(
n=20
)中,总缓解率(
ORR
)为70.0%,12个月的DoR率为83%;而在二线治疗患者(
n=37
)中,ORR为51.4%,mDoR为8.3个月。总体而言,ORR为54.4%,mDoR为18.5个月,中位无进展生存期(
mPFS
)为12.1个月,中位总生存期(
mOS
)为20.4个月(
n=79
),最常见的不良事件(
AE
)为外周水肿、血清肌酐升高和腹泻。总体而言,29.5%的患者发生≥3级治疗相关不良事件(
TRAE
),导致14.8%的患者永久停药。脑转移患者在基线时对特泊替尼的系统反应是强烈和持久的。
使用液体活检和基于RNA的组织活检检测MET ex14跳突的试验显示,两者在预测治疗疗效方面是一致的。
卡马替尼也是一种口服的选择性MET抑制剂,但每天给予2次(
BID
)。卡马替尼是第一个美国FDA批准的用于MET ex14跳突转移性NSCLC靶向治疗的药物,目前已在亚洲日本、韩国、台湾、泰国、香港和印度获批。
GEOMETRY mono-1试验是一项前瞻性、非随机、开放标签的II期研究,评估了卡马替尼的疗效,招募了MET失调晚期或转移性NSCLC患者。接受一线治疗的患者与接受二线和三线治疗的患者相比,ORR、mPFS和DoR更高。造成这种疗效差异的原因尚不清楚,仍在调查中。在MET GCN≥10的患者中,卡马替尼也显示出一些活性信号,未经治疗的患者和经治患者的ORR分别为40%和29%。常见的AEs与替泊替尼相似,包括外周水肿、恶心和呕吐,67%的患者AEs≥3级,治疗相关的停药率为11%。中枢神经系统活性数据有限(
n=13
),54%的患者有颅内反应。
对组织活检来源的RNA,使用RT-PCR技术检测MET ex14跳突,并通过Foundation One CDx NGS (DNA)检测进行回顾性验证。液体活检未被采用。无论突变类型和共突变情况如何,没有看到使用第二个生物标志物来预测潜在应答者疗效的趋势。
赛沃替尼是目前可用的第三种口服选择性MET激酶抑制剂,QD给药。目前,该药物在中国仅被批准用于既往系统治疗后病情进展或无法接受化疗、MET ex14跳突的NSCLC患者。
关于赛沃替尼的单臂II期研究(
NCT02897479
)显示,一线和二线治疗的ORR分别为46.4%和40.55%。最常见的TRAE为外周水肿、恶心、天冬转氨酶(
AST
)/丙氨酸转氨酶(
ALT
)升高、呕吐和低白蛋白血症,46%患者的TRAE分级≥3级。
使用单基因测序或NGS从组织活检中检测MET ex14跳突。
克唑替尼是一种多TKI药物,分别于2011年和2016年获批用于治疗ALK或ROS1重排的晚期NSCLC患者,目前已在许多国家上市。该药最初是为了靶向MET而开发的,因为它对c-MET有强大的活性,并已超适应症用于MET ex14跳突患者。
在MET抑制剂中,关于晚期NSCLC的PROFILE 1001试验拥有最多的数据,尽管克唑替尼的疗效不如MET特异性抑制剂(
ORR为32%,DoR为9.1个月,mPFS为7.3个月
),但如果MET特异性抑制剂不可及,可考虑将克唑替尼作为替代药物。
在关于MET抑制剂的国际指南中,ASCO指南是最新的,推荐卡马替尼或特泊替尼作为ECOG体能状态为0-2、MET ex14跳突、IV期NSCLC患者的一线治疗。
小分子MET抑制剂(
特泊替尼、卡马替尼和赛沃替尼
)现在在一些国家可及。目前还没有直接的头对头临床试验将这些小分子MET抑制剂与克唑替尼进行比较,且这样的研究似乎不可行。这三种MET特异性抑制剂在未经治患者中的疗效似乎高于经治患者,造成这种差异的原因还在研究中且需要进一步的验证。所有药物的AE分析相似,但特泊替尼的3级及更高的AE发生率较低,此外,由于特泊替尼的用法为QD,如果需要AE管理,可采用减剂量的方案(
表3
)。
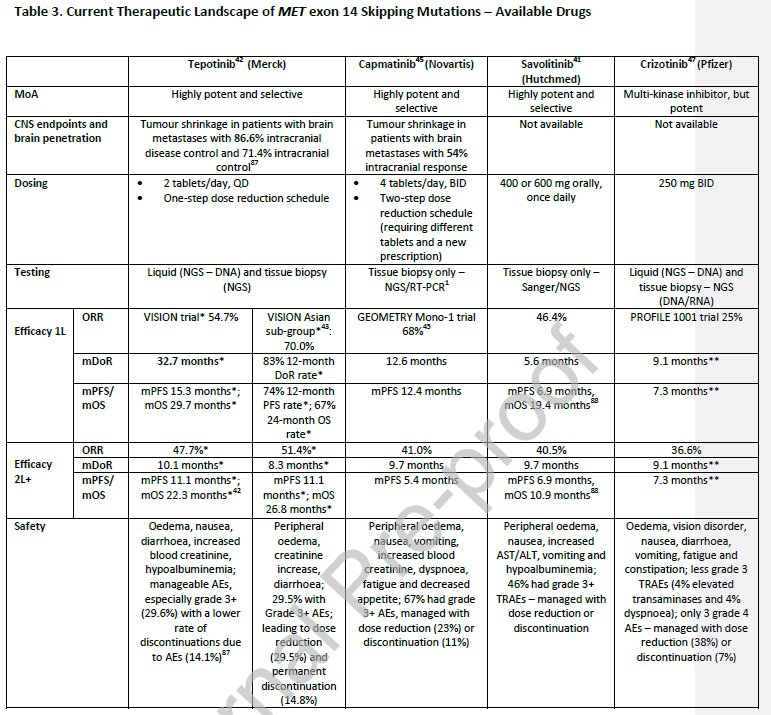
这些药物可考虑用于转移性非小细胞肺癌的一线或二线或后续治疗。由于MET ex14跳突分子检测结果的接收延迟,在给予特定的MET抑制剂之前,许多患者经常接受几个周期的标准护理(SOC)治疗(通常是化疗+/-免疫检查点抑制剂)。
澳大利亚胸肿瘤小组的ASPiRATION研究(
ACTRN1262100022185353
)是一项正在进行的研究,评估所有新确诊的晚期非鳞NSCLC患者的综合基因分析(
CGP
)。目前,在澳大利亚,ASPiRATION和MoST平台关于特泊替尼的亚研究正在招募新确诊的MET ex14跳突患者,以评估MET抑制剂特泊替尼的治疗疗效(
MoST 17:ACTRN12621000811808
),结果预计要到2024年才能揭晓。ASPiRATION研究允许患者在等待CGP结果的同时开始两个周期的SOC治疗。
其他正在研究的药物包括抗体和抗体药物偶联物(ADCs),关于这些药物安全性和有效性的数据仍在评估中
(
表4
)。另一个关于双特异性抗体的I/II期临床试验REGN5093(
NCT04077099
)的结果也在等待中。
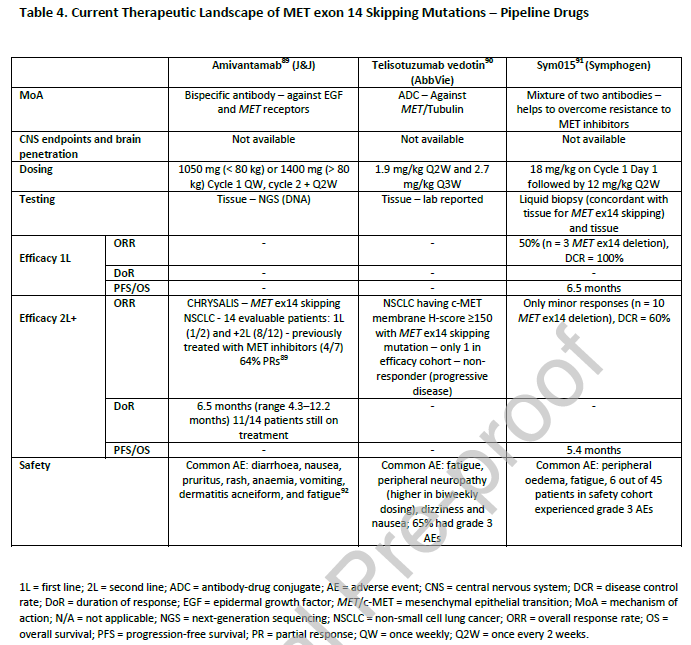
ATORG共识:特泊替尼、卡马替尼和赛沃替尼可以考虑作为MET ex14跳跃变异转移性NSCLC患者的一线或二线或后续治疗。在等待分子检测结果的同时,患者可以接受SOC化疗。如果无法获得MET选择性抑制剂,可考虑将克唑替尼用于二线或后线治疗。
Q4:哪个治疗线(一线vs二线及以上)适合MET抑制剂,特别是对于具有复杂生物标志物表型的NSCLC患者,例如:PD-L1高和MET ex14跳突?
ATORG共识:对于复杂表型的患者(即肿瘤中含有两种可用药生物标志物的患者,如PD-L1和MET ex14跳突或混合组织学的患者),没有评估MET抑制剂靶向治疗与SOC(化疗和/或免疫治疗)治疗结果的比较数据(RCTs),因此,免疫联合化疗治疗仍然是标准治疗,特别是在一线治疗中。虽然回顾性数据表明MET ex14变异患者的PD-L1表达升高,但反应似乎与PD-L1表达无关,这与中位肿瘤突变负荷(TMB)低一致。在提出任何确定的建议之前,需要更多的临床数据。在二线治疗中,在可行的情况下,应考虑MET抑制剂靶向治疗。在疾病进展时,可以考虑重复活检和分子检测来确定主要的分子谱,以指导后续治疗。
Q5:MET扩增在EGFR TKI耐药中的作用是什么?
在EGFR突变的NSCLC患者中,MET扩增与EGFR TKIs耐药相关,因此,克服EGFR TKIs耐药需要同时抑制EGFR和MET。
EGFR突变NSCLC患者在第一代或第二代TKIs治疗后,最终会发生疾病进展,因为获得性突变会导致对这些药物耐药。在接受第三代EGFR TKI(
奥希替尼
)二线治疗后发生进展的患者中,有15%的患者携带MET扩增。FLAURA试验的初步数据还显示,MET扩增是一线奥希替尼治疗后最常见的耐药机制,15%的患者携带MET扩增。
几种EGFR TKIs和MET抑制剂(如特泊替尼、卡马替尼、赛沃替尼、埃万妥单抗和克唑替尼)的联合方案正在研究中,以解决获得性MET扩增
(
表5
)。
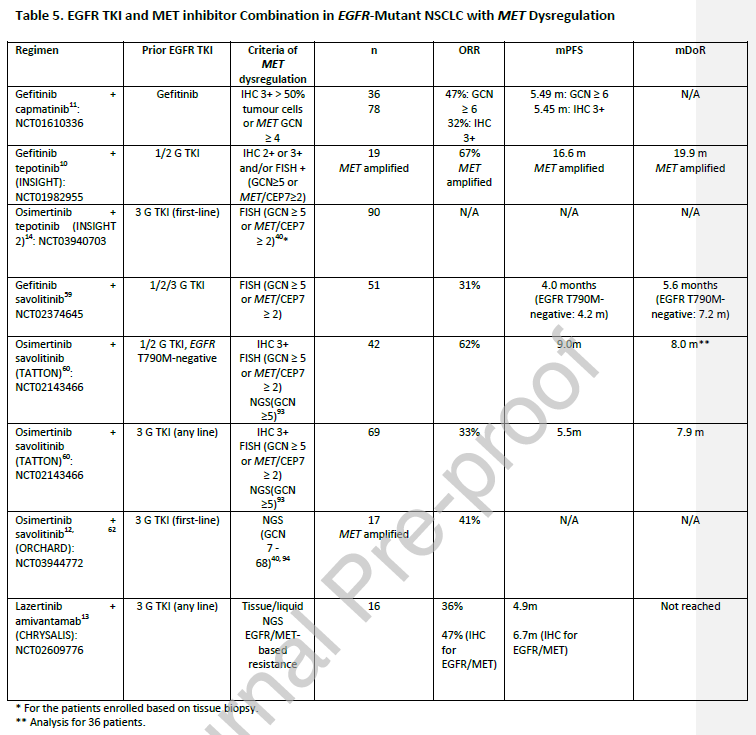
INSIGHT研究是一项开放标签随机试验,评估与培美曲塞和顺铂或卡铂相比,特泊替尼联合吉非替尼在既往接受EGFR TKI治疗发生耐药的NSCLC患者中的疗效。在MET扩增患者中,mPFS为16.6个月(
化疗组为4.4个月
)。INSIGHT 2研究正在评估特泊替尼联合奥希替尼治疗EGFR突变NSCLC的疗效,该NSCLC因MET扩增而对一线奥希替尼获得性耐药。
卡马替尼联合吉非替尼
在EGFR TKI耐药、MET失调的NSCLC中进行了研究,在MET阳性(
定义为GCN≥6
)患者中观察到的最佳ORR最高(
47%
),而IHC 3+肿瘤患者的最佳ORR为32%。
在EGFR突变、MET扩增晚期NSCLC中研究了赛沃替尼联合吉非替尼,总体ORR在EGFR T790M阴性、阳性和未知患者中分别为52%(1
2/23
)、9%(
2/23
)和40%(
2/5
)。在TATTON研究中,在42例EGFR TKI(
第一代或第二代
)进展患者和T790M阴性NSCLC患者中,奥希替尼联合赛沃替尼显示了62%的ORR,这些患者IHC/FISH和NGS检测显示携带阳性生物标志物。在TATTON的另一个队列中,评估奥希替尼联合赛沃替尼在第三代EGFR TKI耐药NSCLC患者中的疗效,ORR为33%。这些结果在SAVANNAH试验中得到了进一步探索,该试验目前正在研究奥希替尼联合赛沃替尼应用于EGFR突变NSCLC患者,这些患者曾接受过奥希替尼治疗进展。ORCHARD试验也是评估赛沃替尼在一线奥希替尼治疗进展EGFR突变NSCLC患者中疗效的II期研究。中期分析仅纳入17例患者,ORR为41%。需要更大规模、更长期的研究来进行后续探索。
CHRYSALIS是一项关于埃万妥单抗和拉泽替尼的I期研究,用于治疗EGFR突变的NSCLC患者。使用的生物标志物为EGFR/MET免疫组化阳性,综合H评分超过400。结果显示,在45例患者中,ORR为36%,mPFS为4.9个月,对于EGFR/MET耐药生物标志物阳性的患者,ORR更高(
47%
),mPFS更长(
6.7个月
)。免疫组化分析表明,EGFR/MET高表达可能是识别潜在应答者的一种替代方法,但这种生物标志物需要进一步验证。
综上所述,MET扩增是与EGFR TKI治疗相关的一种常见耐药机制,MET抑制剂和EGFR TKIs联合治疗EGFR突变的NSCLC患者已经显示出了很好的疗效,这些患者之前因MET扩增而导致EGFR TKIs治疗失败。EGFR TKIs和MET抑制剂联合应用于EGFR突变、伴MET失调NSCLC患者通常显示30-50%的ORR和10个月的mDoR。
ATORG共识:EGFR TKIs是晚期EGFR突变NSCLC的一线标准治疗方法。最近的数据显示,由于获得性MET扩增,各种MET抑制剂联合EGFR TKIs对一线EGFR TKIs进展患者显示活性。然而,除了后续出现更多的比较数据,以及药物在临床中非常可及,对于MET扩增(导致EGFR TKI耐药)的EGFR突变NSCLC患者,目前的SOC是化疗。可根据毒副作用和患者的意愿,进行个性化治疗。ATORG建议将患者纳入临床试验,这些临床试验评估选择性MET抑制剂和EGFR TKIs联合治疗在EGFR突变NSCLC患者中的疗效,以便获得可靠的临床数据。
Q6:到目前为止,临床试验中选择的合适生物标志物是什么?
定义MET扩增的标准因不同的检测方法而不同,观察MET抑制剂益处的阈值还没有明确定义。使用FISH和NGS对MET扩增的阈值进行确定仍有待实施,在埃万妥单抗和拉泽替尼的联合研究中,通过IHC检测的潜在生物标志物EGFR/MET需要进行更多的验证。
ATORG共识:迄今为止,关于EGFR TKIs和MET抑制剂联合使用的临床研究主要处于I期或II期,MET FISH检测应在临床试验招募时主要考虑。FISH可用于检测MET扩增。由于NGS对MET GCN的准确推断,以及在多种耐药机制检测中的适用性,NGS可能在检测MET变异方面发挥更广泛的作用。对于一线EGFR TKIs治疗进展后的T790M阳性EGFR突变NSCLC患者,建议不进行MET扩增检测。然而,对于EGFR T790M突变的NSCLC患者,接受奥希替尼作为二线治疗,也可能在疾病进展时获得MET扩增,因此该亚组应进行MET扩增检测。
在亚太地区,关于MET变异检测和MET抑制剂的可及性,存在相当大的异质性。
关于诊断检测,亚太地区的一些国家(
包括新加坡、日本、中国、澳大利亚、韩国和马来西亚
)可使用商用NGS panel检测NSCLC基因变异,但这只在韩国和日本得到报销。只有一小部分诊所能够使用较新的液体活检方法。用于MET ex14跳突检测的定制RNA/DNA panel在菲律宾等国被使用。然而,目前并不是所有定制的检测panel都将MET纳为标准基因进行检测。对于MET扩增,不同国家FISH、IHC和NGS的检测可及性更加不一致。在越南,检测MET ex14跳突和MET扩增的试验只在正在进行的临床试验中可用。
ATORG共识:与MET检测相关的诊断挑战包括缺乏标准化、没有国家资助的项目等等。ATORG小组建议MET ex14检测应该是多基因panel检测的一部分,以发现可用药变异,此外,应使用经当地验证的检测。
Q8:在亚太地区是否可获得选择性MET抑制剂,这些抑制剂是否有资格获得医疗报销?
只有少数亚太地区批准了选择性MET抑制剂的临床应用(
图1
)。特泊替尼在澳大利亚、日本、韩国、香港、新加坡、中国大陆和台湾均可使用,但只有在日本可以报销,在新加坡,患者可以通过国家项目获得补贴。卡马替尼在香港、日本、韩国、新加坡、台湾和泰国获批,同样只在日本提供报销,在新加坡,可通过国家项目获得补贴。赛沃替尼只在中国获得批准。在马来西亚和菲律宾等国,可以通过正在进行的临床试验或慈善计划获得其中一些抑制剂以及埃万妥单抗等新型药物。
ATORG共识:在选择性MET抑制剂的可及性和报销方面,地区之间存在相当大的异质性。鉴于这些药物在治疗携带这种特定致癌驱动因子NSCLC患者方面的临床益处,ATORG小组相信,这份共识出版物将有助于提高亚太地区的科学意识,并最终获批这些靶向治疗。
ATORG小组建议在晚期和转移性NSCLC患者中应将检测MET突变(MET ex14跳突)作为检测致癌驱动基因突变多基因panel的一部分。对于MET ex14跳突患者,应考虑MET特异性抑制剂作为一线治疗,或作为一线治疗进展后的挽救性治疗。ATORG小组还鼓励患者参加临床试验(如INSIGHT214和SAVANNAH61试验),以评估选择性MET抑制剂和EGFR TKIs在携带获得性MET扩增、EGFR突变NSCLC患者中的疗效。
ATORG小组认为,随着MET特异性抑制剂在不同地区的临床应用,这些共识建议将提高对最佳实践的认识。此外,ATORG小组相信,这一立场声明可能有助于在更广泛的NSCLC可用药生物标志物分子图谱中实施MET标准化检测,并有助于亚洲地区获得MET特异性靶向治疗。
Asian Thoracic Oncology Research Group (ATORG) Expert Consensus Statement onMET alterations in NSCLC: Diagnostic and Therapeutic Considerations. Clinical Lung Cancer Available online 23 August 2022.DOI: https://doi.org/10.1016/j.cllc.2022.07.012
点击加入基因俱乐部 成就行业精英
目前已有500+行业精英加入基因俱乐部




























![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()




 个人中心
个人中心
 我是园区
我是园区





