您还不是认证园区!
赶快前去认证园区吧!


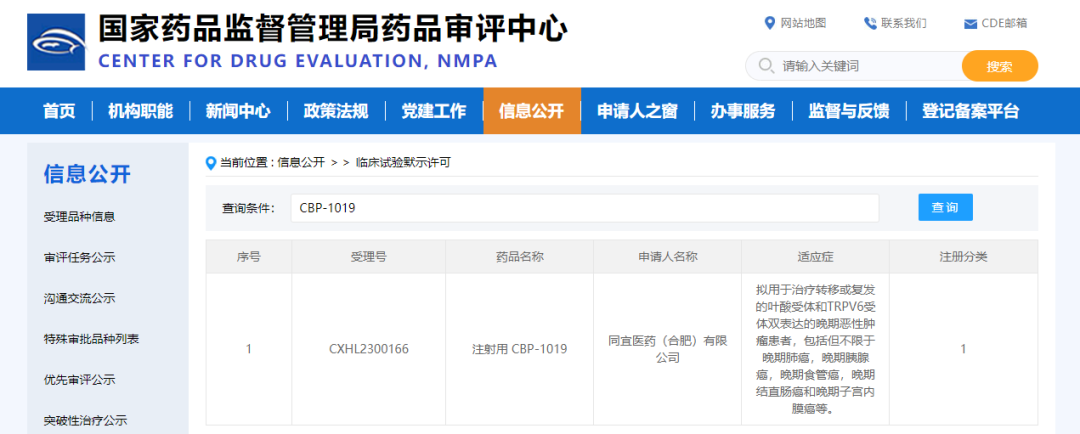
4月14日,CDE网站显示,合肥高新区企业同宜医药(合肥)有限公司(以下简称“合肥同宜医药”)开发的双配体偶联药物CBP-1019获临床试验默示许可,拟用于治疗转移或复发的叶酸受体和TRPV6受体双表达的晚期恶性肿瘤患者,包括但不限于晚期肺癌,晚期胰腺癌,晚期食管癌,晚期结直肠癌和晚期子宫内膜癌等。

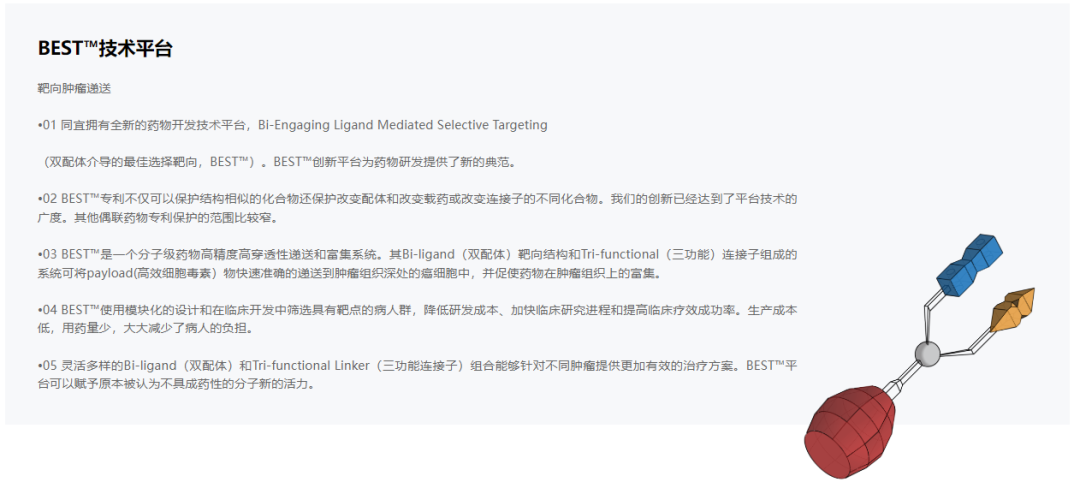
CBP-1019是同宜医药基于专有的Bi-XDC技术平台(BESTTM生物技术平台)研制的新一代双配体小分子药物偶联体,也是同宜医药第3款获批临床的双配体偶联药物。不同于基于第一代Bi-XDC平台开发的CBP-1008和CBP-1018,基于第二代Bi-XDC平台开发的CBP-1019的血浆稳定性更好且治疗窗口更宽。
临床前研究表明,CBP-1019具有显著的抗肿瘤活性和良好的安全性。在包括肺癌、卵巢癌、胰腺癌、食管癌和消化道癌的多个肿瘤模型中,CBP-1019均表现出明显的抑瘤效果和剂量相关性,且动物体重无明显下降,表现出很好的安全性。
合肥同宜医药该产品已于今年1月获FDA批准临床,此次新获CDE批准临床,合肥同宜医药也正式启动在中、美开展CBP-1019在晚期恶性肿瘤患者中安全性和耐受性、药代动力学及初步疗效的非随机、开放、首次用于人体(FIH)的国际多中心I/II期临床研究。
更多内容,欢迎关注合肥高新发布微信号

 扫码关注我们
扫码关注我们


信息来源:高新区投促局
通讯员:李亮

推荐阅读



“转、赞、看”
点亮“在看”保持优秀的习惯!↓↓↓



 个人中心
个人中心
 我是园区
我是园区




