
责编 | 兮
脂肪组织是高等动物重要的贮能器官,与肥胖等代谢性疾病的发生息息相关,根据其功能和形态的不同,可分为白色脂肪组织(white adipose tissue, WAT)、棕色脂肪组织(brown adipose tissue, BAT)和米色脂肪组织(beige adipose tissue)(图1)。WAT所占比例最高,广泛分布于皮下组织和内脏周围,其中储存了大量三酰甘油,并能作为内分泌器官分泌adipokines调节能量代谢;BAT随着动物发育逐渐减少,其中高丰度的解偶联蛋白1(uncoupling protein 1, UCP1)能够使呼吸链与氧化磷酸化解偶联,抑制ATP合成,促进能量以热能形式释放。而寒冷或β-肾上腺素受体激动剂刺激等能够诱导WAT通过WAT棕色化(browning)转变为米色脂肪组织,米色脂肪组织兼具WAT和BAT的特点,通常与WAT相似,但寒冷刺激会诱导其UCP1表达,促进机体产热【2】。可见,促进WAT棕色化,诱导BAT和米色脂肪细胞通过产热消耗能量是缓解肥胖等代谢疾病的潜在有效手段。
糖原是哺乳动物储存糖类的主要形式,人体内糖原稳态有赖于糖原合酶与糖原磷酸化酶(两种限速酶)的调节,两种酶活性受到可逆的磷酸化调控,磷酸化后糖原合酶活性降低,而糖原磷酸化酶活性升高。糖原靶向蛋白(Protein targeting to glycogen, PTG)能够与糖原以及(去)磷酸化酶结合,特异性调节糖原合成与分解【3】。之前研究发现,PTG在脂肪组织中高度富集,但脂肪组织中糖原含量远低于肌肉和肝脏等器官,脂肪中的糖原含量在营养状态变化时受到急性调控(acute regulation)【4】。然而,糖原稳态是否能够影响寒冷等应激状态下WAT棕色化以及产热等能量代谢过程,目前仍不清楚。
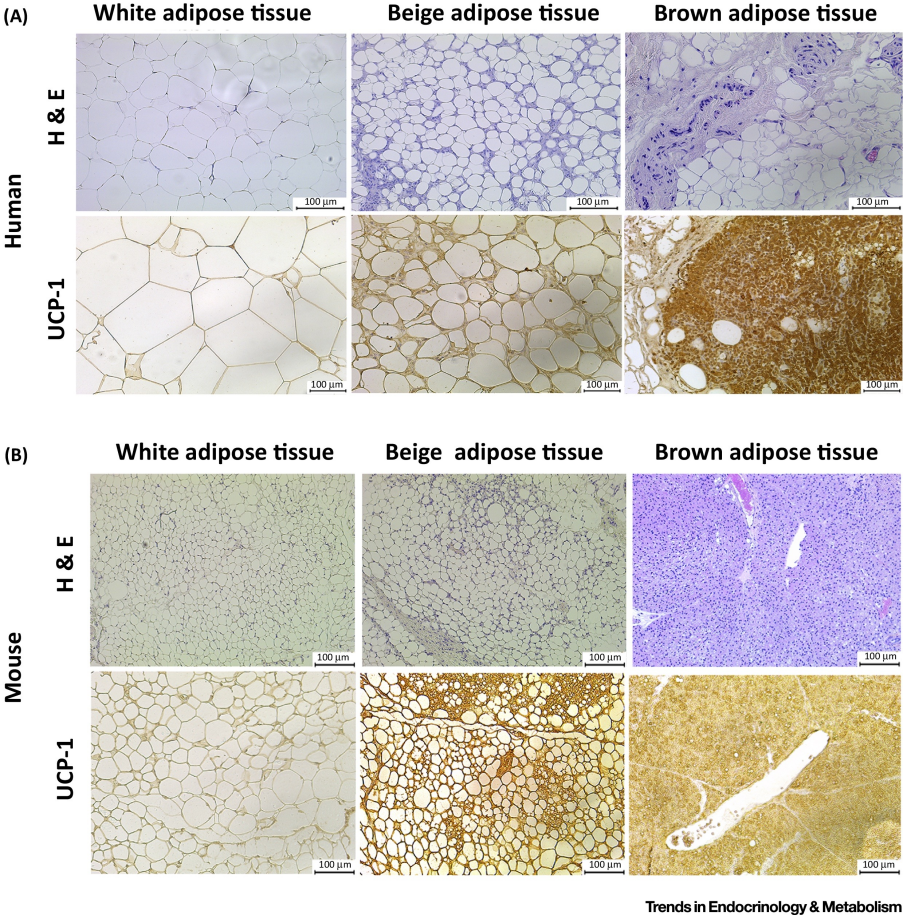
图1 人(A)与小鼠(B)体内不同脂肪组织的形态特征【1】WAT:单房性结构,线粒体少,不表达UCP1;BAT:多房性,大量线粒体,UCP1表达高;米色脂肪组织:兼具WAT与BAT特征,多房性结构,线粒体丰富,表达UCP1。
2021年10月27日,加州大学圣地亚哥分校(UCSD)Alan R. Saltiel教授领衔在Nature杂志发表了题为 Glycogen metabolism links glucose homeostasis to thermogenesis in adipocytes 的研究文章,发现脂肪细胞中糖原合成和周转不仅能调节WAT棕色化,还能通过影响 ROS 生成而调节p38 MAPK的活化,继而诱导 Ucp1 和其他产热控制基因的表达,最终调控寒冷等应激状态下小鼠的能量消耗及代谢反应,本研究揭示了糖原代谢调节WAT棕色化及米色脂肪组织产热基因表达与能量消耗的新机制。

之前研究发现脂肪组织中的糖原水平与机体的营养和节律状态具有相关性【5】,作者推测糖原水平可能受到儿茶酚胺—β-肾上腺素信号的调节。首先,作者证实WAT中β-肾上腺素信号的激活会诱导米色脂肪组织产生,以及UCP1和产热相关基因表达的上调,并促进米色脂肪组织中的糖原合成(图2)。其次,利用PTG基因敲除(KO)小鼠模型,作者发现激活PTG-KO小鼠的β-肾上腺素信号会导致其脂肪组织中糖原积累相比野生型小鼠减少,产热基因表达降低。针对β-肾上腺素信号激活后PTG-KO与野生型小鼠的RNA-seq分析结果同样证明了糖原是脂肪组织中UCP1和产热基因表达的关键调控因素。
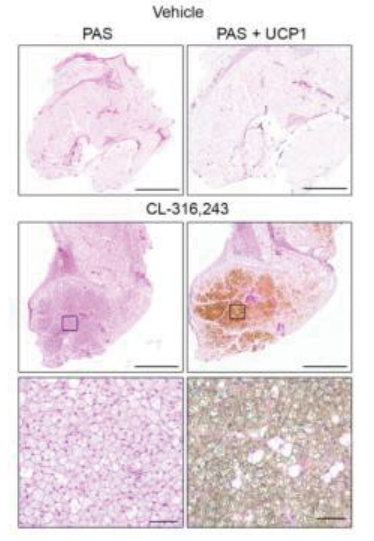
图2 β-肾上腺素信号激活会诱导脂肪组织中糖原积累及UCP1表达
接下来,作者构建了脂肪组织特异性PTG敲除(PTG-AKO)小鼠,β-肾上腺素信号激活后,PTG-KO与PTG-AKO小鼠WAT中UCP1的表达水平显著降低,糖原合成减少,表明脂肪组织特异性糖原代谢能够直接影响UCP1的表达,继而影响产热。而与野生型小鼠相比,诱导β-肾上腺素信号并不能上调PTG-AKO小鼠的耗氧量与CO2生成量,也无法减轻PTG-AKO小鼠体重,高脂膳食也不能诱导PTG-AKO小鼠发生肥胖,表明PTG-AKO小鼠的能量消耗出现异常,也暗示了正常和肥胖小鼠的适应性产热需要糖原代谢的调节。而对不同性别人群的队列分析也表明糖原合成基因的表达与肥胖程度呈现负相关,脂肪组织中糖原代谢基因表达越高,受试人群的体重越低,胰岛素敏感性越高。
随后,作者诱导WAT来源的脂肪前体细胞进行体外分化,并检测了β-肾上腺素激活诱导糖原代谢变化的机制。首先,与野生型相比,β-肾上腺素信号激活无法诱导PTG-KO小鼠的糖原积累,而PTG-KO小鼠中糖原分解的终产物也显著减少;其次,β-肾上腺素信号激活后,PTG-KO小鼠分化的脂肪细胞中Ucp1和Dio2等与产热相关的基因表达量显著降低。第三,抑制PKA或p38表达会抑制β-肾上腺素激活所诱导的正常或PTG-KO分化脂肪细胞中Ucp1的表达,而β-肾上腺素激活依赖性的p38表达在PTG-KO脂肪细胞中降低,表明糖原代谢会通过调节p38激活而影响UCP1介导的脂肪产热。
另一方面,β-肾上腺素激活后抑制糖原分解会促进糖原积累,但会抑制p38的激活与Ucp1和Dio2的表达,表明糖原周转对脂肪细胞中p38的激活是必需的。之前研究发现p38激活需要ROS的产生【6】,作者发现分化后的脂肪细胞中p38 的激活和随后 UCP1 表达上调取决于 ROS 的产生。RNA-seq数据表明β-肾上腺素信号激活会导致野生型脂肪细胞中“排毒与氧化活性簇”通路发生富集,而PTG-KO后富集效应缺失,实验证据也证实了PTG敲除会抑制β-肾上腺素激活导致的ROS产生。因此,糖原合成与分解会通过ROS依赖性方式调节p38的激活。
最后,作者研究了糖原代谢对小鼠寒冷适应性的影响。PTG-KO不会影响急性寒冷刺激后小鼠的体温,但会降低寒冷刺激结束返回室温后PTG-KO小鼠BAT的糖原积累。反复寒冷刺激后,PTG-KO小鼠与野生型小鼠相比体温调节发生异常,表明糖原代谢会影响小鼠对长期寒冷的适应能力。此外,寒冷刺激后PTG-KO小鼠BAT中UCP1表达未发生变化,而长期寒冷刺激会导致PTG-KO小鼠耗氧量与CO2生成量降低。因此,糖原代谢对小鼠在长期寒冷刺激下的产热(能量消耗)及温度调节必不可少。
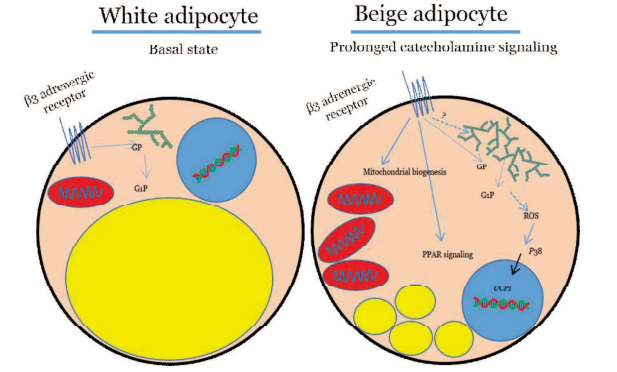
儿茶酚胺—β肾上腺素信号激活后糖原代谢调控脂肪组织产热与能量消耗的机制
综上所述,本研究中作者发现脂肪组织中的糖原代谢对于应激状态下UCP1的表达至关重要,慢性β-肾上腺素信号的激活会诱导WAT棕色化以及米色脂肪组织中糖原的积累,而糖原周转能够促进p38 MAPK发生ROS依赖性激活,进而诱导Ucp1及其他产热相关基因的表达,最终促进能量消耗和体重减轻。
参考文献
1. Abdullahi A, Jeschke M G. White adipose tissue browning: a double-edged sword. Trends in Endocrinology & Metabolism, 2016, 27(8): 542-552.
2. Nedergaard J, Cannon B. The browning of white adipose tissue: some burning issues. Cell metabolism, 2014, 20(3): 396-407.
3. Newgard C B, Brady M J, O'Doherty R M, et al. Organizing glucose disposal: emerging roles of the glycogen targeting subunits of protein phosphatase-1. Diabetes, 2000, 49(12): 1967-1977.
4. Chandler A M, Moore R O. Glycogen deposition in adipose tissue: variations in levels of glycogen-cycle enzymes during fasting and refeeding. Archives of biochemistry and biophysics, 1964, 108(2): 183-192.
5. Carmean C M, Bobe A M, Yu J C, et al. Refeeding-induced brown adipose tissue glycogen hyper-accumulation in mice is mediated by insulin and catecholamines. PLoS One, 2013, 8(7): e67807.
6. Ito K, Hirao A, Arai F, et al. Reactive oxygen species act through p38 MAPK to limit the lifespan of hematopoietic stem cells. Nature medicine, 2006, 12(4): 446-451.
转载须知
【原创文章】BioArt原创文章,欢迎个人转发分享,未经允许禁止转载,所刊登的所有作品的著作权均为BioArt所拥有。BioArt保留所有法定权利,违者必究。




 个人中心
个人中心
 我是园区
我是园区




