▎药明康德内容团队报道
10月8日,礼来公司(Eli Lilly and Company)宣布,其
高选择性转染重排(RET)抑制剂塞普替尼(selpercatinib)
的新药上市申请
已获得中国国家药监局(NMPA)批准,
用于治疗RET基因融合阳性的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者、需要系统性治疗的晚期或转移性RET突变型甲状腺髓样癌(MTC)成人和12岁及以上儿童患者、以及需要系统性治疗且放射性碘难治(如果放射性碘适用)的晚期或转移性RET融合阳性甲状腺癌(TC)成人和12岁及以上儿童患者。
公开资料显示,塞普替尼是首个获批专门用于治疗携带RET基因变异癌症患者的精准疗法。

RET
基因变异包括基因融合和激活性点突变,它们可以导致RET信号通路过度激活,细胞生长不受控制。由于RET致癌基因存在于肺癌、甲状腺髓样癌、甲状腺癌、直肠癌、乳腺癌、胰腺癌等多种癌症中,它已成为了“不限癌种”疗法的重要信号通路之一。携带RET基因变异的癌症主要依靠这一蛋白激酶的异常激活促进它们的增殖和生长,因此这些癌症对RET抑制剂非常敏感。
塞普替尼是一款高度特异性、强力口服RET抑制剂,它不但可以抑制天然RET信号通路,也可以抑制可能出现的获得性抗性。2020年5月,FDA批准塞普替尼上市,治疗携带RET基因融合或者突变的非小细胞肺癌(NSCLC)、髓样甲状腺癌和甲状腺癌患者。
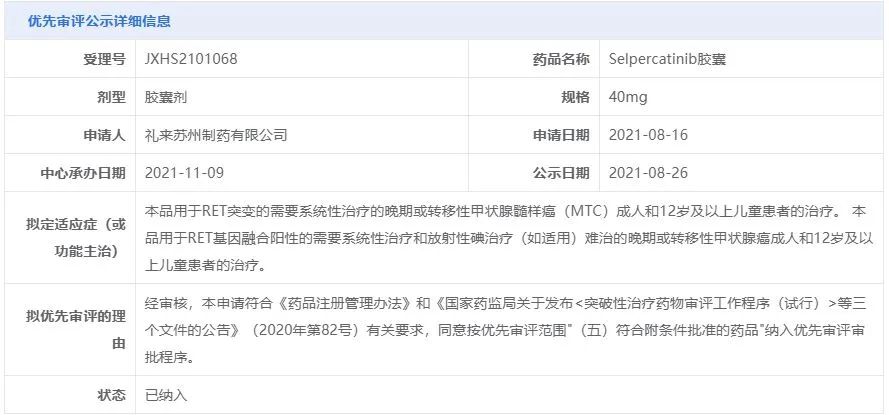
2021年11月,
中国国家药品监督管理局药品审评中心(CDE)受理了
塞普替尼
胶囊的
上市申请
,并将其纳入优先审评。
2022年3月,礼来公司与信达生物进一步深化肿瘤领域的战略合作,其中包括信达生物获得塞普替尼在中国的独家商业化权利。
根据礼来公司新闻稿,此次塞普替尼在中国获批是基于全球研究LIBRETTO-001数据和LIBRETTO-321研究中国人群数据。
其中,LIBRETTO-001研究是一项评估塞普替尼治疗RET驱动型癌症患者的全球1/2期临床试验。研究终点主要的疗效考量是确认的客观缓解率(ORR)和中位缓解持续时间(DoR)。
研究结果显示,对于RET融合阳性的局部晚期或转移性NSCLC患者,独立影像学数据委员会(IRC)评估的ORR为84.1%和中位DoR分别为20.2个月;对于RET突变型的晚期或转移性MTC患者,IRC评估的ORR超过73.5%,中位DoR未达到;对于RET融合阳性的晚期或转移性TC患者,IRC评估的ORR为92%,中位DoR未达到。表明塞普替尼对三种患者均具有缓解率高,持续时间久的优势。
LIBRETTO-321研究是一项旨在评估塞普替尼用于中国RET变异晚期实体瘤患者疗效与安全性的开放标签、多中心、2期临床试验,共入组77例RET基因变异晚期实体瘤中国患者。研究结果显示,中国数据与LIBRETTO-001全球数据具有高度一致性,验证了塞普替尼在中国人群中良好的疗效与安全性。
希望塞普替尼早日来到患者身边,为他们带来新的治疗选择。
参考资料:
[1]礼来高选择性RET抑制剂塞普替尼在中国获批,惠及RET驱动型肺癌和甲状腺癌患者 . Retrieved Oct 8, 2022. From https://mp.weixin.qq.com/s/xD5mz96v6KxerXJ6WNjeng
[2] 《新英格兰医学杂志》发布Retevmo™(selpercatinib)在RET驱动的晚期肺癌和甲状腺癌中的I/II期临床研究数据. Retrieved Aug 27,2020, from https://mp.weixin.qq.com/s/fIc9eVDPZWe4xDekDh-PFQ
本文由药明康德内容团队根据公开资料整理编辑,欢迎个人转发至朋友圈。转发授权请在「医药观澜」微信公众号留言联系我们。其他合作需求,请联系wuxi_media@wuxiapptec.com。
免责声明:药明康德内容团队专注介绍全球生物医药健康研究进展。本文仅作信息交流之目的,文中观点不代表药明康德立场,亦不代表药明康德支持或反对文中观点。本文也不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。







 个人中心
个人中心
 我是园区
我是园区




