来源:器械之家

FDA紧急授权了DiabetOmics公司的侧向层析检测法的临床使用,该方法可在15分钟内得出检测结果
FDA首次批准了不使用血液样本,仅仅需要简单无痛的口腔拭子就行的新冠肺炎抗体测试剂CovAb。
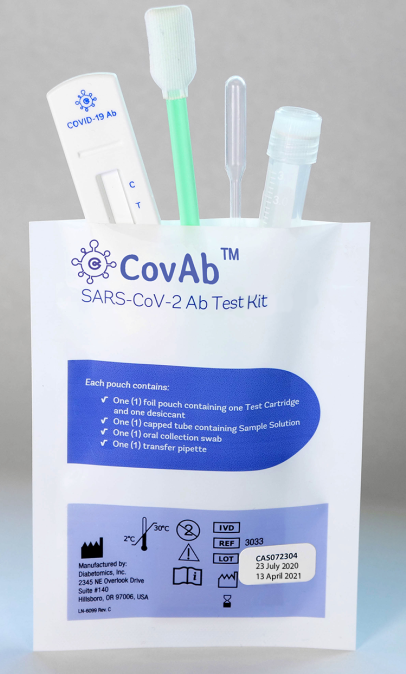
CovAb
这项由DiabetOmics公司开发的快速侧向层析检测法(lateral-flow diagnostic)获得了成人和儿童临床应用的机构紧急授权。
该测试在15分钟内得出结果,不需要任何额外的硬件或仪器。
据该公司称,在人体出现新冠肺炎感染症状至少15天后,身体的免疫反应达到更高水平时,该测试的假阴性率低于3%,假阳性率接近1%。
这款检测试剂(CovAb)可检测IgA、IgG和IgM抗体,此前获得了欧盟颁发的CE标志(安全认证标志)。在美国,由DiabetOmics公司的子公司COVYDx销售。

DiabetOmics 成立于2008年,是一家全球化的医疗诊断公司,开发出一项创新的非接触性诊疗技术,可广泛用于糖尿病、高血压等慢性病及其并发症的诊断与检测。该公司日前获得400万美元C轮合作,合作方为Ventureeast。

Lumella
该公司此前还推出了一款产品Lumella用于怀孕前三个月的先兆子痫临床检测。
这种潜在的危险并发症可能表现为高血压和器官损伤,但可能没有其他征兆。
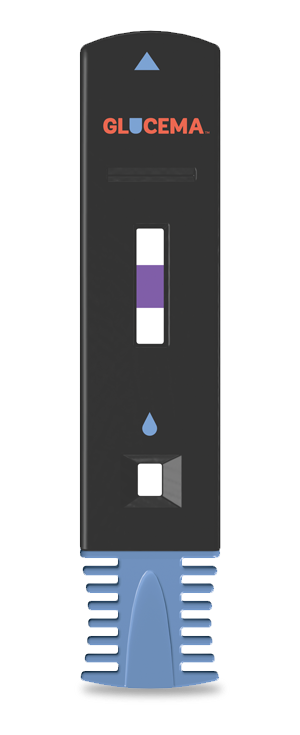
Glucema
DiabetOmics公司曾致力于开发一种基于唾液的检测产品Glucema,来检测II型糖尿病患者的每周血糖水平。
它还致力于开发一项基于血液的检测,用于早期诊断儿童及成人的I型糖尿病。
随后DiabetOmics公司将其研究成果运用在了新冠疫情中。
最近,抗体测试开始更清晰地描绘出新冠肺炎在美国流行最初几个月的情况。
证据显示新冠病毒早在宣布国家紧急情况之前就已到达美国海岸,并且有数百万至数千万的潜在无症状病例未被发现。
美国国立卫生研究院进行了一项名为“All of Us”的人民健康数据计划,这项研究收集了数万名参与者的干血纸片(dried blood spot-DBS)样本。研究发现在2020年头几个月收集的样本中含有新冠病毒抗体,这表明早在2019年12月(不排除更早之前)美国各地就出现了感染。
另一项招募了240,000多名参与者的研究发现,截至去年夏天,官方报告的病例数可能少了近2000万。研究人员估计,每1例确诊病例背后就隐藏了近5人未被确诊。这些发现基于美国红十字会的调查报告,报告显示在那个时期的献血中发现了新冠病毒抗体。
关于如何获得FDA的EUA批准,我们器械之家将于
2021年6月29日(周二)准时在器械之家视频号给大家
直播详解:北美FDA监管政策及EUA申请指南,点击下方按钮预约直播。
1.本文版权归器械之家(ID:qixieke4008228766)所有。
2.媒体与其他公众号欲转载稿件,请务必通过文末留言提出申请,经回复许可后方可转载。
3.转载须在“标题下+正文前”位置标注来源、作者。
4.未经授权删减转、截图转、用于商业用途、不按照要求标明来源和作者,一律追责与投诉到底。
商务合作:4008228766@qixieke.com













 个人中心
个人中心
 我是园区
我是园区




