君实生物PD-1抗体一线晚期NSCLC达到临床主要终点
收藏
关键词:
抗体终点临床PD-1君实生物
资讯来源:医药合作投融资联盟 + 订阅账号
所属行业:化学原料药 + 订阅行业
发布时间:
2020-12-14
近日,上海君实生物医药科技股份有限公司产品特瑞普利单抗(商品名:拓益®,产品代号:JS001)联合化疗一线治疗晚期非小细胞肺癌的随机、双盲、多中心的 III 期临床研究(以下简称“CHOICE-01 研究”,Clinicaltrial.gov 登记号:NCT03856411)在期中分析中,由独立数据监察委员会(IDMC)判定达到了预设的主要研究终点。公司将于近期向国家药品监督管理局递交新适应症上市申请。
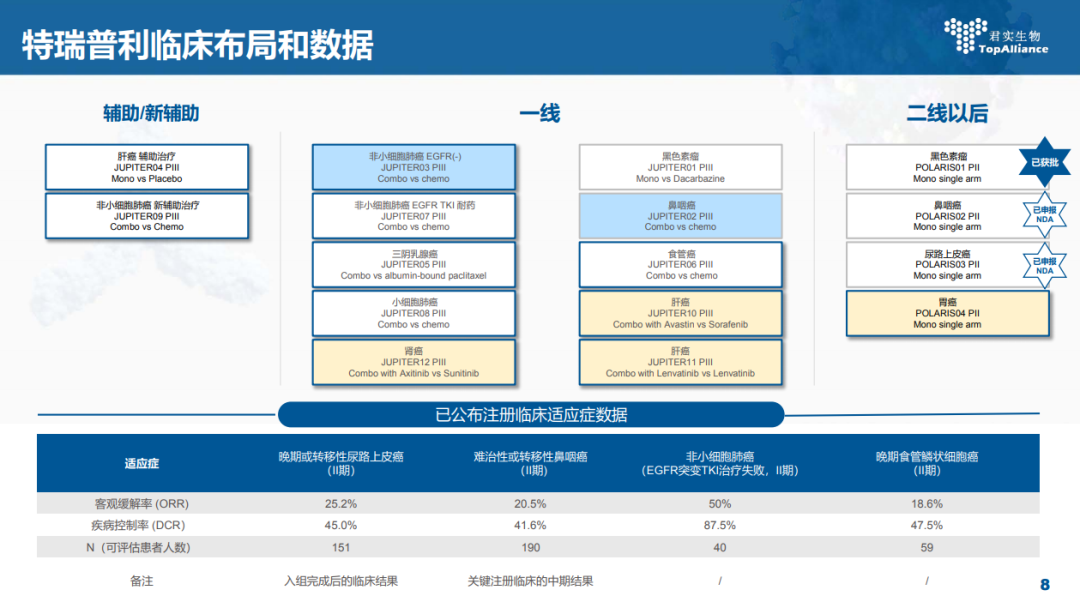
特瑞普利单抗是中国首个批准上市的以 PD-1 为靶点的国产单抗药物。特瑞普利单抗自 2016 年初开始临床研发,至今已在中、美等多国开展了覆盖超过 15个瘤种的 30 多项临床研究。2018 年 12 月 17 日,特瑞普利单抗获得国家药监局有条件批准上市,用于既往接受全身系统治疗失败的不可切除或转移性黑色素瘤的治疗。特瑞普利单抗用于三线治疗复发╱转移性鼻咽癌,以及特瑞普利单抗用于二线治疗转移性尿路上皮癌的新适应症上市申请分别于 2020 年 4 月和 2020年 5 月获得国家药监局受理。2020 年 7 月,上述两项新适应症上市申请已于被国家药监局纳入优先审评程序。2020 年 9 月,特瑞普利单抗用于治疗复发/转移性鼻咽癌获得美国食品药品监督管理局突破性疗法认定。
CHOICE-01 研究是一项随机、双盲、多中心的Ⅲ期临床研究,旨在评估特瑞普利单抗联合标准一线化疗对比安慰剂联合化疗,在未经治疗的晚期鳞状和非鳞状非小细胞肺癌患者中一线治疗的有效性与安全性。该研究由中国医学科学院肿瘤医院王洁教授担任主要研究者。
CHOICE-01 研究是国内首个将抗 PD-1 单抗联合化疗作为一线治疗,在晚期鳞状和非鳞状非小细胞肺癌两种组织学亚型患者中开展的 III 期临床研究。CHOICE-01 研究实际入组 465 例非小细胞肺癌患者,其中鳞状非小细胞肺癌患者 220 例,非鳞状非小细胞肺癌患者 245 例。该研究的主要研究终点为无进展生存期(PFS),次要研究终点为总生存期(OS)、客观缓解率(ORR)、缓解持续时间(DOR)、疾病控制率(DCR)以及安全性等。
根据 CHOICE-01 研究期中分析结果,独立数据监察委员会(IDMC)判定该研究主要研究终点无进展生存期达到方案预设的优效界值,特瑞普利单抗安全性数据与已知风险相符,未发现新的安全性信号。



 药选址
药选址

