


抗体疗法是指利用抗体来治疗疾病。单克隆抗体 (mAb) 是由 B 细胞在特异性抗原刺激下产生的免疫球蛋白。抗体可以在人体免疫系统中发挥重要作用,辅助机体对抗原的体液和细胞免疫应答,具有高特异性和持久性。自1986年美国食品药品监督管理局 (US FDA) 批准首个 mAb 抗CD3 OKT3(也称为muromonab-CD3)以来,mAb已成为一类主要治疗药物。
截至2022年06月30日,已批准上市的抗体治疗数量已达162种,针对的适应症包括癌症、免疫相关疾病、感染性疾病和血液疾病等。抗体疗法的优势源于其高特异性和优化的亲和性。此外,抗体疗法的安全性和有效性与其靶点的特性有关,尤其是靶标的表达模式及其在疾病进展中的作用。
癌症和免疫相关疾病中的部分靶点已得到充分验证,如PD-1/PD-L1、CD20、TNF-α、HER2和CD3。基于这些靶点开发了大量的抗体用于相关疾病的治疗。随着疾病发病机理及相关信号通路的发现,越来越多的抗体被开发用于更多种类的疾病的治疗。近年来,新型冠状病毒(SARS-CoV-2) 刺突蛋白(Spike蛋白)和中枢神经系统 (CNS) 疾病中的降钙素基因相关肽 (CGRP) 也引起了广泛得关注。
1997年,全球抗体疗法市场规模仅为0.3亿美元,到2021年迅速增至1860亿美元。而且,数千项抗体正处于临床或临床前的开发阶段。据估计到2028年,全球抗体市场规模将达到4450亿美元。从2022年到2028年,抗体市场复合年增长率 (CAGR) 为13.2%。抗体疗法市场增长迅速,在美国、欧洲、日本和中国的医疗健康产业中显示出巨大的市场潜力。获批抗体数量最多且市场份额最大的药物开发企业位于美国,这也是耐于其对药物开发和研发的长期投资。美国的市场地位其次是欧洲,而在过去五年中,中国和日本的公司数量以及获批上市抗体数量快速增长。
在本综述中,我们参考 Umabs 治疗性抗体数据库 (Umabs-DB) 的数据,对全球范围内至少被一家药品监管机构批准的抗体(不包括生物类似药、诊断抗体和兽用抗体)进行统计分析。本文首先统计了不同地区药品监管机构逐年批准的抗体药物的情况,了解不同地区抗体药物获批的趋势。然后,本文进一步分析不同年份获批抗体的格式,深入了解了不同抗体格式以及抗体改造技术的演化和发展。此外,本文还讨论了抗体药物的靶点和疾病,展示了全球抗体药物研发的进展。最后,不同国家和地区抗体研发的机构也进行了分析,以此预测抗体疗法未来的发展趋势。

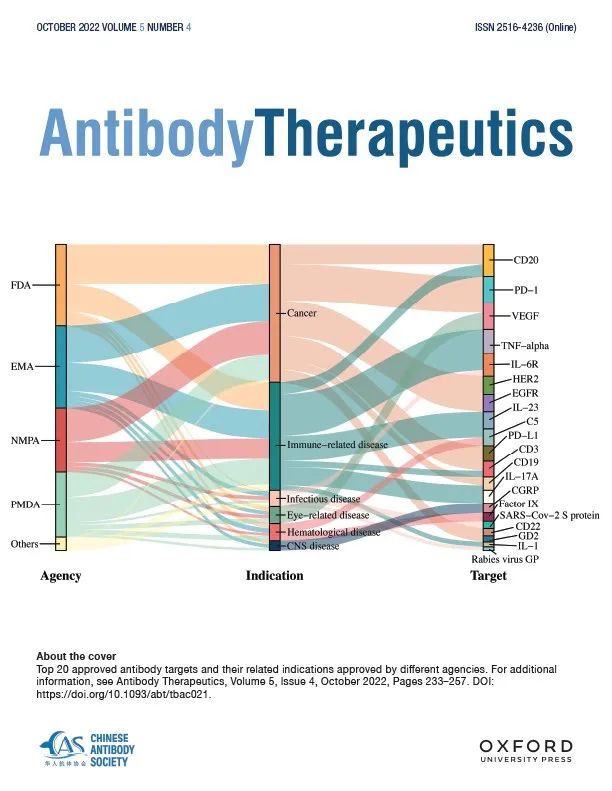
截至2022年06月30日,全球范围内一共有162种抗体药物被至少一个药品监管机构批准上市,其中9种后来被撤回。在此次统计分析数据中不包括生物类似药、诊断抗体和兽用抗体。不同地区在不同年份批准的抗体治疗数量概述见图1。
从批准数量来看,约93%的获批抗体药物首次由4家主要药品监管机构批准,分别是美国FDA、欧洲药品管理局 (EMA)、日本药品和医疗器械管理局 (PMDA) 和中国国家药品监督管理局 (NMPA)(补充图1)。其余7%的抗体药物首次在加拿大、巴西、古巴、印度或俄罗斯获批。历史上,FDA、EMA、NMPA和 PMDA 在20世纪90年代开始批准抗体药物上市。在162种获批的抗体中,FDA已批准122种,EMA已批准114种(包括EMA正式成立前欧洲国家批准的4种),NMPA已批准73种,PMDA已批准82种。
在这篇综述中,我们重点关注FDA、EMA、PMDA和NMPA这四个药品监管机构在不同年份批准抗体的信息。如果一种抗体首次被以上四个药品监管机构以外的机构批准,则仅提供首次批准信息,但未列出此抗体在其他地区的批准情况。

我们的数据显示,美国的批准抗体药物数量最多,远远领先于其他国家和地区。第一个抗体药物 (OKT3) 于1986年获得 FDA 批准,之后用了8年的时间才等到第二个抗体药物的批准。第二个获批抗体阿昔单抗(Abciximab)在1994年获批。它与血小板表面的糖蛋白Ⅱb/Ⅲa受体结合,以阻断纤维蛋白元,VWD因子和其它有粘性的分子与受体位点结合,从而抑制血小板聚集防止形成血栓,堵塞血流而致心肌急性缺血。与血小板表面的糖蛋白Ⅱb/Ⅲa受体结合,以阻断纤维蛋白元,VWD因子和其它有粘性的分子与受体位点结合,从而抑制血小板聚集防止形成血栓,堵塞血流而致心肌急性缺血。2000年以后,FDA每年至少批准一种抗体药物。这使得美国在二十多年来主导了抗体药物批准的数量。
1991年,奈巴库单抗(Nebacumab)首次在欧洲获批用于治疗细菌感染导致的败血症。尽管 Nebacumab因未能在后续临床验证中未能明显降低死亡率而在1993被撤回,但它是迄今为止唯一获批的 IgM 抗体。在欧洲获批的第二个抗体药物是依决洛单抗(Edrecolomab),于1995年获批。Edrecolomab是一种靶向 EpCAM 的鼠源抗体,用于治疗结直肠癌 。1995年至2014年间,EMA每年批准的抗体数量少于5个。但2015年以后,EMA每年批准的抗体数量增加到10种左右。
在抗体药物批准数量和临床试验方面,日本和中国比美国和欧洲落后10年左右。但是,在过去十年中,日本和中国在抗体药物开发方面取得了长足的发展和瞩目的成果。第一个在日本批准的抗体是2001年批准的靶向 CD52 阿仑单抗(Alemtuzumab),此抗体是由赛诺菲旗下健赞公司(Genzyme,Sanofi)开发的用于治疗白血病的人源化抗体。2005年,首个由日本当地开发的抗体托珠单抗(Tocilizumab)在日本获批。Tocilizumab是一种靶向白介素6受体 (IL-6R) 的人源化抗体,用于治疗关节炎。此后,日本的批准抗体药物数量稳步增加,尤其是2014年之后。
中国NMPA(前CFDA)在1999年批准了首个抗体药物。这是一家古巴公司开发的鼠源CD3 抗体IOR-T3,用于治疗器官移植排斥反应 。2002年,中国批准了一种当地开发的抗体Wut3,该抗体也是一种用于治疗移植排斥反应的鼠源 CD3 抗体。在2017年之前,中国每年批准的抗体疗法数量不到5种。但2018年以后,中国每年的抗体药物批准数量增加到10个以上,甚至在2021年达到18个。
尽管中国 NMPA 批准的抗体疗法共有73种,其中由本土公司研发的抗体仅有18种。最近,中国首个抗体类原创一类新药(first in class)卡杜尼利单抗(Cadonilimab)获批。Cadonilimab是靶向 PD-1/CTLA-4的双特异性抗体 ,被 NMPA 批准用于治疗转移性宫颈癌。Cadonilimab是全球获批的首个具有双重免疫检查点抑制的双特异性抗体,是中国创新抗体疗法开发的重要突破。

1975年,Georges Köhler和César Milstein建立了基于鼠 B 细胞和骨髓瘤细胞融合的杂交瘤平台,此技术使得体外大量生产单克隆抗体 成为可能。随后,通过结构域重组形成的嵌合抗体,以及主要通过互补决定区 (CDR) 移植获得的人源化抗体,被用于单克隆抗体的改造。此外,噬菌体展示、酵母展示、哺乳动物细胞展示 、转基因动物 和单B细胞技术的进展大大加速了全人源抗体的开发。
值得注意的是,噬菌体展示开发的抗体不完全是天然存在的抗体,因为其重链和轻链序列可能不是来自相同的 B 细胞。最近,糖基化改造也成为优化抗体药效和药代动力学特性的有力工具。例如,临床上已证实 Fc 核心岩藻糖基化与抗体的FcγRIIIa结合和抗体依赖性细胞毒性 (ADCC) 活性有关。去岩藻糖基化的抗体其IgG-Fc 受体IIIa(FcγRIIIa) 亲和力增加 ,从而提高ADCC 活性。目前批准的无岩藻糖基化抗体有4种:Obinutuzumab、Mogamulizumab Benralizumab和Inebilizumab。
所有批准的抗体中,啮齿类动物原生抗体总数仅为11种,其中4种已撤回。1986年,第一个鼠源抗体OKT3 靶向 T 细胞表面表达的 CD3,临床上用于抑制器官移植排斥反应。2019年鼠源抗体 Rabimabs 在印度获批用于治疗狂犬病以来,之后未有动物源原生抗体获批用于人类疾病的治疗。第一个获批的双特异性抗体是抗 CD3/EpCAM 的Catumaxomab。Catumaxomab是一种小鼠-大鼠杂交双特异性抗体,2009年由 EMA 首次批准用于胃癌的治疗。Moxetumomab pasudotox是唯一一种鼠源抗体偶联毒素,2018年获得 FDA 批准用于治疗毛细胞白血病 (HCL)。
动物源抗体直接用于人体给药存在风险和缺点。例如,小鼠抗体注入患者身体后,患者会产生针对鼠抗体的人抗小鼠抗体 (HAMA),快速清除注入体内的小鼠抗体,大大缩短了抗体的半衰期。此外,不能有效的激活患者体内的ADCC效应 ,也大大降低了部分抗体的药效。为了克服动物源抗体的这些问题,嵌合抗体技术和人源化抗体技术逐步发展起来。

Figure 2: Antibody discovery and engineering for approved antibodies. A: Antibody therapies of different degree of humanization: a: the non-human antibody; b: the chimeric antibody, where the variable region (green region) is from a non-human animal, and the other domains (blue region) is from human; c: humanized antibody, where only the hypervariable region fragment is non-human; d: full human antibody. B: Different engineering formats of approved antibody therapies: a. canonical antibodies; b. fragments: including Fab fragment, single-chain variable fragment (scFv), Fc fragment, the variable regions of camelid heavy-chain-only antibodies (VHH) fused with human Fc fragment or with another VHH; c. antibody drug conjugates (ADCs): monoclonal antibody conjugate with cytotoxic small molecule drug payloads; d. bispecifics: including heterodimeric bispecific antibody, scFv-scFV bispecific antibody such as bispecific T-cell engager (BiTE) and IgG-scFv-based tetravalent; e. others: including antibody-conjugate immunotoxin, radiolabeled canonical antibody, radiolabeled Fab fragment, Fc-fusion protein, a scFv fused with a soluble TCR, and an IgG fused with an enzyme. C: The number of different formats of antibody therapies for the year that they were first approved (Fc-fusion proteins are not included).
嵌合抗体指将动物源抗体的可变结构域(Variable region)与人源抗体恒定区(Constant region)重组获得的一类抗体。一共有16种嵌合抗体疗法以不同的抗体形式获批,包括全长IgG、抗体片段和ADC。1994年,FDA批准了第一个嵌合抗体,阿昔单抗(Abciximab)。2006年,NMPA也批准了碘131标记的嵌合抗体I131-美妥昔单抗(Iodine 131- Metuximab),用于肝癌的治疗。此外,2021年,FDA批准了一种抗体偶联药物 loncastuximab tesirine 用于大B 细胞淋巴瘤的治疗。这表明嵌合抗体药物在某些场景中仍然会使用。
人源化抗体将动物源抗体的互补决定区(CDR 区)移植到人源抗体对应的框架序列中形成的抗体。抗体人源化之后,抗体免疫原性大大降低,但通常亲和力也会降低。临床上已经有很多方法被开发出来,用于恢复和增加抗体亲和力和特异性。作为抗体改造的重要方法, 人源化抗体被批准的数目达到66个。1997年,FDA批准了首个人源化抗体药物,靶向CD25 的达利珠单抗(Daclizumab)用于抑制器官移植的排斥反应。此后,人源化抗体药物在每年获批的抗体药物中所占比例都很高。
1990年,Gregory P. Winter开发噬菌体展示平台用于抗体片段的筛选。噬菌体展示将抗体基因序列整合到噬菌体基因组中重组表达,并在噬菌体表面展示,用于抗体的特异性和亲和力筛选。转基因动物为全人源抗体的开发提供了另一种强大的技术。1994年,将小鼠进行基因工程改造将人源IgG编码基因导入小鼠体内,同时敲除小鼠内源IgG编码基因,从而使小鼠在免疫后表达全人源抗体。
此外,单B 细胞技术直接从人血液中直接分离抗原特异性B细胞,用于生成人天然抗体。到目前为止,共有55种全人源抗体疗法获得批准。1991年,第一个全人源抗体治疗药物 IgM 抗体 Nebacumab 获批。2002年,FDA批准了阿达木单抗(Adalimumab)用于相关免疫疾病的治疗。阿达木单抗是首个获批的全人源化IgG 抗体,该抗体是基于噬菌体展示技术开发。单B细胞的技术已成功应用于病毒中和抗体的开发,此技术直接从康复病人血清中直接分离能与病毒抗原结合的B细胞并确认抗体中和活性。2020年,FDA 批准的了靶向埃博拉病毒表面糖蛋白的抗体组合REGN-EB3 。2022年,EMA批准了靶向 SARS-CoV-2 刺突蛋白抗体组合的Evusheld 。
二代测序 (NGS) 最新进展使其成为抗体快速发现的有力武器。随着抗体发现技术的不断进步,我们相信从创新平台中发现的抗体疗法将引领新一波抗体药物的浪潮。
抗体的格式改造以及基于抗体的新型疗法也是抗体药物的重要研究领域。本文也统计了获批抗体的不同格式。我们将所有获批的抗体药物分为5类:典型抗体、抗体片段、ADC、双特异性抗体和其他形式。典型抗体具有完整的抗体结构,由两条全长重链和两条轻链组成。在所有获批的抗体中,115种为典型抗体,其中114种为IgG,另一种为IgM (Nebacumab)。抗体片段由抗体的一个或几个结构域组成,但片段本身可以作为药物发挥作用。抗体片段包括 Fab 片段、单链可变片段 (scFv)、Fc片段和纳米抗体 (VHH) 等。抗体片段可以单独使用,也可以互相连接,甚至进行进一步的修饰如PEG修饰或放射性标记等。到目前为止共有8种片段抗体药物获批。
ScFv是一种小尺寸抗体,仅包含抗体的重链可变区和轻链可变区,因此具有更强的组织穿透性。唯一批准的 scFv 是靶向VEGF-A的 Brolucizumab,用于治疗湿性老年性黄斑变性,于2019年获得 FDA 批准。目前已批准了4个 Fab 片段,其中首个获批的 Fab 药物为阿昔单抗(Abciximab)。此外,PEG修饰的Fab抗体Certolizumab Pegol 于2008年获批用于自身免疫相关疾病的治疗 。唯一的 Fc 片段Efgartigimod alfa 于2021年首次获得 FDA 批准,靶向新生儿Fc 受体 (FcRn),用于治疗重症肌无力征。Caplacizumab和 Envafolimab是基于VHH开发的两个抗体,分别于2018年和2021年首次获得 EMA 和 NMPA 批准。Caplacizumab是一种二价的纳米抗体,由两个VHH连接而成(VHH-VHH),而 Envafolimab 采用 VHH-Fc 融合形式,提高抗体的活性。
ADC 由单克隆抗体以及作为有效载荷的小分子药物化学偶联组成。到目前为止,已有14种 ADC 获批。双特异性抗体是一类工程化抗体或抗体片段,能够同时靶向两个抗原或同一抗原的不同表位。迄今为止,已有7种双特异性抗体获批。双特异性抗体具有不同的结构:包括异二聚体双特异性抗体 (Catumaxomab、Emicizumab、Amivantamab、Faricimab、Mosunetuzumab),基于 scFv 的双特异性抗体【双特异性 T 细胞衔接器 (BiTE) (Blinatumomab)】和基于 IgG-scFv的四价抗体(Cadonilimab)。另外,一些基于抗体的新型疗法,我们将其并入“其他”组,包括抗体偶联毒素(moxetumomab pasudotox)、放射性标记抗体(Iodine 131 derlotuximab biotin, Iodine 131 Tositumomab)、放射性标记 Fab 片段(Iodine 131 Metuximab)、Fc融合蛋白、scFv抗体与 TCR 融合蛋白 (Tebentafusp) 以及抗体与酶融合蛋白 (Pabinafusp alfa)。

抗体与其靶标抗原结合后会引发一系列的生理效应,包括阻断配体、阻断受体二聚化、介导受体内化、抗体依赖性细胞吞噬作用 (ADCP)、抗体依赖性细胞毒性 (ADCC) 和补体依赖性细胞毒性 (CDC) 。
治疗靶点的验证需要大量的研究投入,使得临床开发的靶点数量非常有限。162种获批的抗体疗法涉及91个靶点。一些靶点已被广泛研究,如PD-1、CD3、CD20、EGFR、VEGF和HER2,因此大部分已批准的抗体治疗都是基于这些靶点,这些靶点都是癌症和免疫相关疾病靶点 。值得注意的是,CD3被用作 T 细胞依赖性双特异性抗体的靶点,而不是作为癌症治疗的直接肿瘤靶点。此外,最近出现了其他靶标,如用于新冠治疗的 SARS-CoV-2 Spike蛋白抗体(Regdanvimab、Amubarvimab + Romlusevimab、Sotrovimab和Evusheld)和以及 CNS 疾病治疗的CGRP抗体(Fremanezumab、Galcanezumab和Eptinezumab)。

所有获批抗体中,112个抗体靶向30个靶标,其余63个抗体则靶向剩余61个靶点。针对这30个靶点的抗体药物中,7个是双特异性抗体,1个是抗体鸡尾酒治疗(Relatlimab + Nivolumab),2个是典型抗体(Ustekinumab和Bimekizumab),2个是 Fc 融合蛋白(Abatacept和Belatacept),1个是针对2个靶点开发的免疫偶联物(immunoconjugate)(Tebentafusp)(因此统计了两次),在这些热门靶点上产生了研发的高度集中和随之而来的激烈市场竞争。最受欢迎的20个靶点主要应用于癌症治疗(PD-1/PD-L1、CD20 、VEGF 、EGFR 、HER2 、CD3 、CD19 、CD22 、GD2 )、免疫相关疾病 (TNF-α 、IL-6R 、IL-23、IL-17A 、IL-1)、感染性疾病(SARS-CoV-2刺突蛋白 、狂犬病病毒GP)、CNS疾病 (CGRP ) 和血液类疾病(C5、凝血因子IX)。抗体的监管机构以及对应的靶点进行了分析和展示,由此可以窥见不同地区不同的医疗保健需求。
随着疾病机理和研发技术研究的深入,抗体靶点也随之变化。在排名前20个靶点中,有一些“新”靶点出现(PD-1/PD-L1、CD19、SARS-CoV-2刺突蛋白、CGPR、狂犬病毒 GP 和IL-6R),这些靶点的抗体在2011年以后才获批。相比之下,2010年之后就没有靶向TNFα的抗体获批。2018年,免疫检查点 PD-1 的发现获得诺贝尔生理学或医学奖。PD-1作为肿瘤微环境中T 细胞的“刹车”信号,被认为是许多肿瘤治疗的关键靶点。而新冠 在全球的大流行,人们全力加速开发发现用于预防或治疗 新冠的中和抗体,到目前为止共批准了4种抗体疗法。
针对获批抗体的适应症,我们根据其病理学将其分为7类。其中近一半(42.6%) 的抗体药物是针对癌症,37%是针对免疫相关疾病,11%是针对传染病,7.4%是针对血液病,而其他适应症的抗体只占不到3%。同样,随着时间的推移,对不同适应症的研发重点也发生偏移。如前所述,癌症一直是抗体治疗的最大适应症。获批用于癌症治疗的第一款抗体药物利妥昔单抗(Rituximab)是一种靶向 CD20 的嵌合IgG1 单克隆抗体,其1997年被 FDA 批准用于治疗非霍奇金淋巴瘤。利妥昔单抗作为一种嵌合抗体在临床上取得很好的疗效,归功于它引起外周 B 细胞迅速和几乎完全耗竭,这缓解了嵌合抗体给药引入的免疫原性问题。抗体疗法由于其疗效、特异性、时效性和耐受性,彻底改变了免疫相关疾病的治疗。需要注意的是,自2016年以来,CNS疾病一直是抗体疗法的一个新兴治疗领域,其中部分抗体可能会带来一些突破性的治疗方法。

按照至少一个获批的抗体来统计不同地区的公司,共有82家公司有抗体类药物获批。首次在FDA获批抗体的公司数量为33家,EMA为15家公司,NMPA为17家,PDMA为7家,其他机构为10家。公司的数量也表明,美国在抗体治疗方面处于领先地位,主导了抗体领域的研究和临床开发。FDA、EMA和PMDA在2016年至2020年批准了大多数的抗体。而,2021年首次获得 NMPA批准上市抗体的研发公司数量达到峰值(8家公司)。这表明,在过去十年中,中国在该领域投入了大量的研究经费和资本。

Figure 4: A. Companies with their first approval by different regulatory agencies (the MHRA from the UK is included in the Others group). B. Top 10 companies ranking by the number of approved antibody therapies.
对获批抗体数量最多的前10家公司,根据获批抗体适应症进行分类比较,体现了不同企业在癌症、免疫相关疾病、传染病、血液病和 CNS 疾病等疾病领域有不同的研发重点。GSK、BMS、安进和礼来在癌症领域展现出更强的兴趣,分别有5、4、3和3个抗体批准。相比之下,它们在免疫相关疾病方面有2、2、2和1个抗体药物获批,这是它们的第二大治疗领域。强生、阿斯利康和诺华在免疫相关疾病方面表现出更高兴趣,分别有6、3和3个抗体批准,这超过了它们在癌症方面的批准数量。罗氏、赛诺菲和再生元在癌症(8、2和2个批准)和免疫相关疾病(8、2和2个批准)的抗体治疗方面相对平衡。阿斯利康和赛诺菲则对血液类疾病进行了更多探索(2次和2个批准)。同样,感染性疾病的是 GSK 和阿斯利康关注点(2和2个批准),而眼部相关疾病的治疗仅有罗氏和诺华成功开发(2和1个批准)。

抗体疗法已经成为一系列人类疾病治疗的领先方法。目前世界上已经批准了160多种抗体疗法,但这只是一个开始。新兴的抗体发现技术加速了抗体的开发,将更多的抗体候选物领向临床开发。目前有几种抗体发现技术获得广泛应用,包括杂交瘤技术、体外展示技术(噬菌体展示、酵母展示和哺乳动物细胞展示等)和单 B 细胞技术。在 新冠大流行期间,通过分离患者血液中的单 B 细胞发现的几种中和抗体已被批准或紧急授权使用。Bamlanivimab (LY-CoV555) 是首个获得 FDA 紧急使用许可治疗 新冠感染的抗体。通过单个B 细胞分离、NGS和机器学习算法的结合,公司仅用了几个月就完成了中和抗体的早期发现。NGS、生物信息学和人工智能(AI) 也正在推进抗体发现,寻找和生成具有更好药理学特性的新抗体分子。我们相信NGS、生物信息学和大数据领域的发展将持续加速抗体开发。抗体发现技术的进步以及新抗体靶标的发现也将结合起来,推动抗体疗法解决临床应用的需求。
在过去十年中,免疫检查点抑制剂PD-1/PD-L1 彻底改变了多种癌症的治疗。靶向PD-1/PD-L1抗体成功推动了癌症免疫疗法的发展。到目前为止,全球范围内不同监管机构已批准了12种靶向 PD-1 的抗体(Pembrolizumab、Nivolumab、Sintilimab、Cemiplimab、Toripalimab、Tislelizumab、Camrelizumab、Prolgolimab、Penpulimab、Dostarlimab、Zimberelimab和Serplulimab)和5种靶向 PD-L1 的抗体(Atezolizumab、Durvalumab、Avelumab、Sugemalimab和Envafolimab)。
此外,靶向 CTLA-4 和 PD-1 的双特异性抗体(Cadonilimab) 和靶向 LAG-3 和 PD-1 的抗体鸡尾酒疗法 (Relatlimab + Nivolumab) 也于今年获批。然而,在免疫检查点相关抗体中,只有抗 CTLA-4 和抗 LAG-3 抗体与抗 PD-1/PD-L1 抗体联合显示出有前景的疗效;它可能有助于克服在既往治疗中观察到的局限性。除 PD-1/PD-L1 抗体外,其他免疫检查点抗体疗效有限,迫使研发人员积极寻找其他肿瘤免疫治疗的新靶点。
在过去的四十年里,抗体应用模式也发生了重大的变化。传统抗体治疗是基于蛋白质的分子,包括典型抗体、ADC、双特异性抗体和抗体片段。最近,华人抗体学会 (CAS) 引入了 AntibodyPlus TM的新概念,用于展望未来的抗体治疗。AntibodyPlus TM疗法包含不同“新”抗体和/或其他应用模式,如细胞和 mRNA 表达抗体药物。毫无疑问,其中CAR-T细胞疗法越来越受到关注。FDA已经批准了5种 CAR-T 细胞疗法(Abecma 、Breyanzi 、Kymriah、Tecartus和Yescarta)用于治疗血液恶性肿瘤。随着增强 CAR-T 细胞疗法疗效的新策略的引入,我们很快就会看到CAR-T在实体瘤治疗的突破。
此外,抗体治疗的一个新趋势是 mRNA 编码的抗体。将编码抗体的mRNA通过不同形式注射到体内表达规避了抗体复杂的生产和纯化过程、同时解决了的抗体表达固有的翻译后修饰异常的问题。此外,mRNA表达可以简化抗体鸡尾酒的生产 。基于 mRNA 的抗体疗法的潜力是新一代抗体疗法最有吸引力的方面之一。
尽管取得了这些进展,抗体疗法仍然是世界上增长最快的治疗形式之一。这是通过持续的研发投入和新兴市场的成熟来实现的。未来全球抗体治疗产业及其市场将大幅扩大。





 个人中心
个人中心
 我是园区
我是园区





