「 本文共:15条资讯,阅读时长约:3分钟 」


君实XPO1抑制剂获FDA临床许可。君实生物与微境生物共同开发的XPO1抑制剂WJ01024片(JS110)的IND申请获得FDA批准。JS110特异性阻断XPO1蛋白功能,抑制包括p53在内多种抑癌蛋白出核,加强抑癌蛋白功能。在肿瘤动物模型中,JS110单药或者联用可抑制多种血液和实体肿瘤生长。目前,JS110正在中国开展I期临床(NCT04991129)。君实拥有JS110的全球权益。


1.三叶草新冠疫苗对青少年人群有效。三叶草生物三聚体重组蛋白新冠疫苗SCB-2019(CpG 1018╱铝佐剂)在青少年人群(12-17岁)中进行的国际II/III期临床达到主要终点。结果显示,青少年人群较青壮年人群(18-25岁)显示出高出约2倍的中和免疫反应;SCB-2019具有良好的安全性及免疫原性特性。疫苗组及安慰剂组的安全性相似,该结果与在成年人群中观察到的相当。三叶草已计划下半年完成向NMPA、EMA和世卫WHO递交SCB-2019的附条件上市批准。
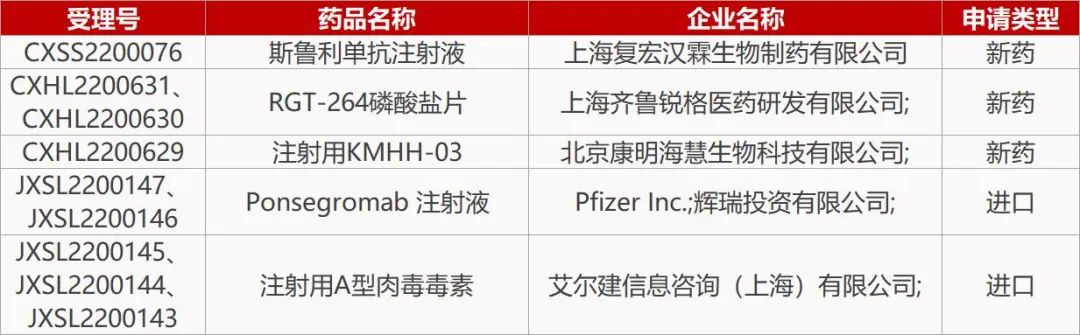
2.复宏汉霖PD-1抑制剂新适应症报产。复宏汉霖PD-1抑制剂斯鲁利单抗注射液的新适应症上市申请获CDE受理。这是该产品在中国递交的第四项上市申请,推测为「联合化疗用于食管鳞癌的一线治疗」。今年5月,斯鲁利单抗在一项Ⅲ期ASTRUM-007研究中达到双重主要终点,斯鲁利单抗联合化疗对比安慰剂联合化疗显示出明显的无进展生存期(PFS)和总生存期(OS)改善,且联合治疗安全性良好。
3.司美格鲁肽中国减肥III期临床积极。诺和诺德长效GLP-1受体激动剂司美格鲁肽注射液已在中国完成III期临床(CTR20202040),作为低卡路里饮食和增加体力活动的辅助治疗用于初始体重指数(BMI)≥30kg/m2(肥胖),或≥27kg/m2且<30kg/m2(超重)并且伴有至少一种与超重相关的合并症的成人患者。试验的主要终点为第44周时体重较基线的变化(%)和44周后达到体重减轻≥5%的患者比例。预计即将在华申报减肥适应症。
4.拓新天成TX103靶向CAR-T获批临床。陈列平教授联合创立的拓新天成申报的TX103嵌合抗原受体T细胞注射液获国家药监局临床试验默示许可,拟开发用于TX103阳性的晚期实体瘤经治患者。跨膜蛋白TX103在多种实体肿瘤中高表达,尤其在高级别胶质瘤中表达率达到84%。在临床前研究中,靶向TX103的CAR-T能有效杀伤肿瘤细胞,并能清除小鼠模型中的实体肿瘤,且未观察到明显的副反应。
5.李氏大药厂引进多款儿童用药全球权利。李氏大药厂宣布与Windtree Therapeutics签订新协议,获得后者Surfaxin(KL4表面活性剂)、Surfaxin LS(冻干KL4表面活性剂)、AEROSURF(吸入式视光活性剂)及任何其他含有合成KL4表面活性剂的医药组成物的独家全球开发、生产及商业化权利,主要用于改善早产婴儿呼吸窘迫综合征的管理。其中AEROSURF是以非入侵性方式释放雾化KL4表面活性剂而设计的药物/器械,已获得FDA授予用于呼吸窘迫症候群的快速通道资格。


1.伊布替尼获FDA批准用于儿科cGVHD。FDA批准强生旗下杨森与艾伯维开发的BTK抑制剂Imbruvica(ibrutinib,伊布替尼)新适应症,用以治疗1岁及以上、慢性移植物抗宿主病(cGVHD)的儿童经治患者。一项Ⅰ/Ⅱ期iMAGINE研究25周治疗数据显示,在中位年龄为13岁(范围:1-19岁,n=47)的cGVHD患者中,ibrutinib的总缓解率(ORR)达60%(95% CI:44-74);而且药物用于儿童患者中的安全性与成人患者一致。这是FDA针对这类儿童患者批准的首款疗法,也是Imbruvica获得的FDA批准的第12项适应症。
2.首款罕见血液肿瘤精准疗法获FDA批准。Incyte公司成纤维细胞生长因子受体(FGFR)抑制剂Pemazyre(pemigatinib)获FDA批准第二项适应症,用于治疗FGFR1基因重组的复发或难治性髓系或淋巴系肿瘤(MLNs)。在一项Ⅱ期FIGHT-203试验中,pemigatinib在这类罕见血液肿瘤患者中达到79%(22/28,95% CI:59-92)的完全细胞遗传缓解率。它是首个获批用于治疗携带FGFR1基因重组的MLN患者的精准疗法。
3.马赛替尼治疗ALS在欧盟报产。AB Science公司多激酶抑制剂马赛替尼(masitinib)治疗肌萎缩侧索硬化症(ALS)的附条件上市许可申请获欧洲药品管理局(EMA)受理。在一项II/III期AB10015研究的主要疗效人群中,马赛替尼联用利鲁唑与安慰剂联用利鲁唑相比,第48周时患者的改良ALS功能评定量表(ALSFRS-R)评分的变化组间差异为3.4 (95% CI: 0.65–6.13; p=0.016),使患者的功能衰退率减缓27%。但两组疗效在整体患者群体中无显著性差异。
4.首款TIL疗法递交滚动上市申请。Iovance Biotherapeutics肿瘤浸润淋巴细胞(TIL)疗法lifileucel向FDA滚动提交生物制品许可申请(BLA),用于PD-1/PD-L1治疗后进展的晚期黑色素瘤。一项II期临床C-144-01结果显示,在注册性队列4和队列2中,lifileucel用于接受过PD-1抑制剂和BRAF/MEK疗法的难治性患者中的ORR为31% (95% CI: 24.1%, 39.4%),中位随访27.6个月时未达到中位DOR。在注册性队列4中,lifileucel的ORR为29% (95% 置信区间 (CI): 19.5%, 39.4%) ,中位DOR为10.4个月,中位随访时间为23.5 个月。如果获批,Lifileucel将成为首款TIL疗法。
5.辉瑞双价RSV疫苗Ⅲ期临床积极。辉瑞双价呼吸道合胞病毒(RSV)候选疫苗RSVpreF用于在60岁以上老年人预防RSV导致的下呼吸道疾病的Ⅲ期RENOIR试验结果积极。由外部数据监测委员会(DMC)所进行的预定中期分析结果显示,RSVpreF疫苗对出现2个以上RSV相关下呼吸道疾病(LRTI-RSV)症状的保护率为66.7%(96.6% CI:28.8-85.8),对3个以上LRTI-RSV症状的保护率则达85.7%(96.6% CI:32.0-98.7)。此外,该研疫苗也显示出良好的耐受性,没有安全性的顾虑。辉瑞计划尽快向FDA递交其BLA申请。
6.降血脂新药概念验证Ⅱ期临床积极。89bio公司开发的成纤维细胞生长因子21(FGF21)类似物pegozafermin,在用于治疗严重性高甘油三酯血症(SHTG)的Ⅱ期临床ENTRIGUE达到主要终点。与安慰剂组相比,pegozafermin治疗组第8周时患者中位甘油三酯(TG)值较基线具有统计上显著的下降[56%(p<0.001)、63%(p<0.001)、36%(p<0.05)VS12%]。该试验同时也达到多项次要终点,包含在动脉粥样硬化性脂蛋白、代谢测量以及肝脏脂肪上的改善。药物的总体耐药性良好。


1.出入境人员无需再申报核检信息。根据口岸疫情防控形势,海关总署将于8月31日零时启用第九版《中华人民共和国出/入境健康申明卡》。新版申明卡取消了对出入境人员核酸检测信息、既往感染情况、疫苗接种日期的申报要求;完善或调整了以往出入境人员容易产生疑问的项目,更利于出入境人员理解和填写;增加了在线确定《采样知情同意书》的功能,更加方便进出境旅客简化现场检疫流程。
2.谷歌地图将标注提供堕胎服务的诊所。谷歌日前宣布将推出一项新的标识系统,让人们更容易找到提供他们所搜索服务的地点,或者拓宽他们的搜索结果,看到更多的选项。在更新的标识系统下,提供堕胎服务的医疗机构将增添“提供堕胎”的标签;当无法确认一家机构是否提供堕胎服务时,谷歌将在该机构的标签上写上“可能不提供堕胎服务”。
3.通用流感疫苗可预防病毒变种。美国佐治亚州立大学生物医学研究所研究人员发表在《公共科学图书馆·病原体》杂志上的一项最新研究显示,一种新的通用流感疫苗用在小鼠身上可预防甲型和乙型流感病毒的不同变种。据悉,接种了表现出多种神经氨酸酶亚型和保守的M2部分抗原(诱导免疫反应的外来蛋白)的免疫刺激病毒样颗粒的小鼠,可抵御甲型流感季节性变异、潜在流行性病毒(H1N1、H5N1、H3N2、H9N2和H7N9)和含有大量抗原变异的乙型流感病毒(山形和维多利亚系)。




【拓新药业】拟以不动产方式对子公司精泉生物追加投资3,010.63万元,投资全部计入资本公积,公司仍持有精泉生物100%股权,精泉生物注册资本不变,资本公积增加至3,010.63万元。
【复星医药】(1)子公司复宏汉霖产品HLX60于澳大利亚药品管理局完成临床试验备案,治疗方案亦已获得相关人类研究伦理委员会的批准,产品用于晚期/转移性实体瘤治疗,复宏汉霖拟于条件具备后于澳大利亚开展该治疗方案的I期临床试验。(2)子公司复宏汉霖研发的汉斯状(斯鲁利单抗注射液)联合顺铂和氟尿嘧啶(5-FU)一线治疗局部晚期/复发或转移性食管鳞状细胞癌(ESCC)的药品注册申请获国家药监局受理。
【普利制药】公司于近日收到美国食品药品监督管理局(FDA)签发的硝普钠氯化钠注射液仿制药上市批准通知。
- The End -





 个人中心
个人中心
 我是园区
我是园区




