倒计时5天:连续生物工艺及生产大会-参会指南及最终日程公布
收藏
关键词:
参生物大会
资讯来源:贝壳社 + 订阅账号
发布时间:
2020-09-11

报名要求:生物创新药企+限50人+审核(仅剩10个名额)
ACMC2020-第二届亚洲生物制药连续生产及工艺创新峰会大会将围绕单克隆抗体、抗体偶联(ADC)、双特异性抗体、重组蛋白、基因与细胞治疗等生物制药从研发到商业化生产所涉及到的申报与法规、CMC开发、上下游工艺技术、一次性技术应用、连续流工艺、工艺验证、质量控制以及医药制造智能化等热门话题展开。大会分为3大平行论坛、50+主题分享、30+展商、600+专业观众。欢迎行业专家再聚上海,与会交流。
重磅嘉宾

大会日程
08:50 全球生物药研发的挑战与机会:BsAb and TsAb
09:15 一体化的超高效连续生物工艺的开发和应用
10:05 茶歇及商务交流
10:25 细胞&基因治疗时代中国生物医药的机遇与挑战
范晓虎博士,首席科学官,联合创始人, 南京传奇生物
10:50 中国生物制药行业工艺研发的机会和挑战 :Continuous Bioprocessing
罗顺博士,创始人兼董事长,澳斯康生物制药 & 健顺生物
11:15 生物制药连续生产的挑战 :高风险与高回报平衡
11:40 圆桌讨论:中国生物制创新之路及中国生物制药2030展望
范晓虎博士,首席科学官,联合创始人, 南京传奇生物
罗顺博士,创始人兼董事长,澳斯康生物制药 & 健顺生物
分论坛一 新型疗法开发,抗体偶联药物及双特异性抗体
14:00 ADC药物的商业化生产及工艺放大
李壮林博士,副总裁,烟台荣昌生物
14:30 新一代CTLA-4抗体药物ONC-392研发历程及进展
方显锋博士,研发副总裁,广州昂科免疫
15:00 主题待定
吴幼玲博士,总裁/董事长,浙江特瑞思药业
15:30 茶歇及商务交流
15:50 双抗药物的快速开发策略
陶佳林博士,细胞培养兼细胞株开发执行总监,苏桥生物
16:20 CD38 ADC药物开发与全球ADC药物技术发展趋势
李辉博士,副总裁及中国区总经理,索伦托药业
16:50 圆桌讨论
9月17日
09:00 双特异性抗体开发平台进展工程创新和CMC策略
09:30 改善双特异性抗体生产和质量的策略:工艺开发和设计
10:00 治疗性VEGF-Fc融合蛋白和PD-L1/VEGF双特异性抗体的开发
10:50 Innovative Cell Culture Technologyfor Bispecific Antibody Production
Jana Frank,细胞株构建总监,广州汉腾生物
分论坛二 上下游创新工艺,连续工艺及智能生产4.0
14:00 解决生物药上游开发中的速度和质量矛盾困局
14:30 Continuous Processing for Production of Monoclonal Antibodies
Dr. Scott MWheelwright, COO, BioInno Bioscience
15:50 生物工艺中细胞数量与健康监测的高通量解决方案
李如伟博士,中国区负责人,Nexcelom Bioscience
16:20 Facility Considerations to handle continuous mAb processes
Dr. Nick Kotlarski, COO, Bioworkshops 康日百奥生物
09:00 有关抗体药和前沿药物(ATMP)生产中病毒安全性控制的考量
10:00 多平台方法快速解决IND难题,冲破生物药CMC开发中的挑战
项骏博士,总经理,凯惠睿智生物科技(上海)有限公司
11:20 Connect Downstream with Upstream
李树德 Michael,工程与技术副总裁,天境生物
14:30 生物过程4.0:模型和AI助力连续制造
Dr. DonaldPalahnuk, VP of LSPD-TT, 君实生物
15:30 Bring Your Biologics from Clinic to Market -Key Factors from Process Lock to Commercial Production
Raphael Gräter, Head of Process & Validation, Boheringer Ingelheim
16:00 Integrated ADC Downstream Processing for Empowerment of Biologics
Dr. Rolf Werner, COO, 启德医药
分论坛三 亚洲细胞基因治疗生产及工艺论坛
胡大裕, 首席运营官,阿思科力(苏州)生物科技有限公司
陈皓, CEO, 英诺维尔智能科技(苏州)有限公司
16:50 细胞治疗产品中美IND申报CMC法规要求
10:00 CAR T全自动工艺制备的意义、前景以及风险控制
10:50 如何应对商业规模病毒载体生产的挑战:质量和风险控制的领先实践
由庆睿博士, CDMO事业部运营总监,上海和元生物
11:20 基因与细胞治疗产品申报与质量控制要点解析
14:00 细胞和基因治疗原材料,供应链,质量控制与分析
蒋忻坡博士, QA/QC部的高级总监,南京传奇生物
14:30 CAR-T细胞治疗的临床转化-机遇与挑战
张鸿声博士,同济大学医学院兼职教授,雅科生物创始人
左为教授,吉美瑞生/仙荷医学创始人兼总裁,同济大学医学院教授
朱逸博士,中国及亚太区负责人,T-Cure Bioscience
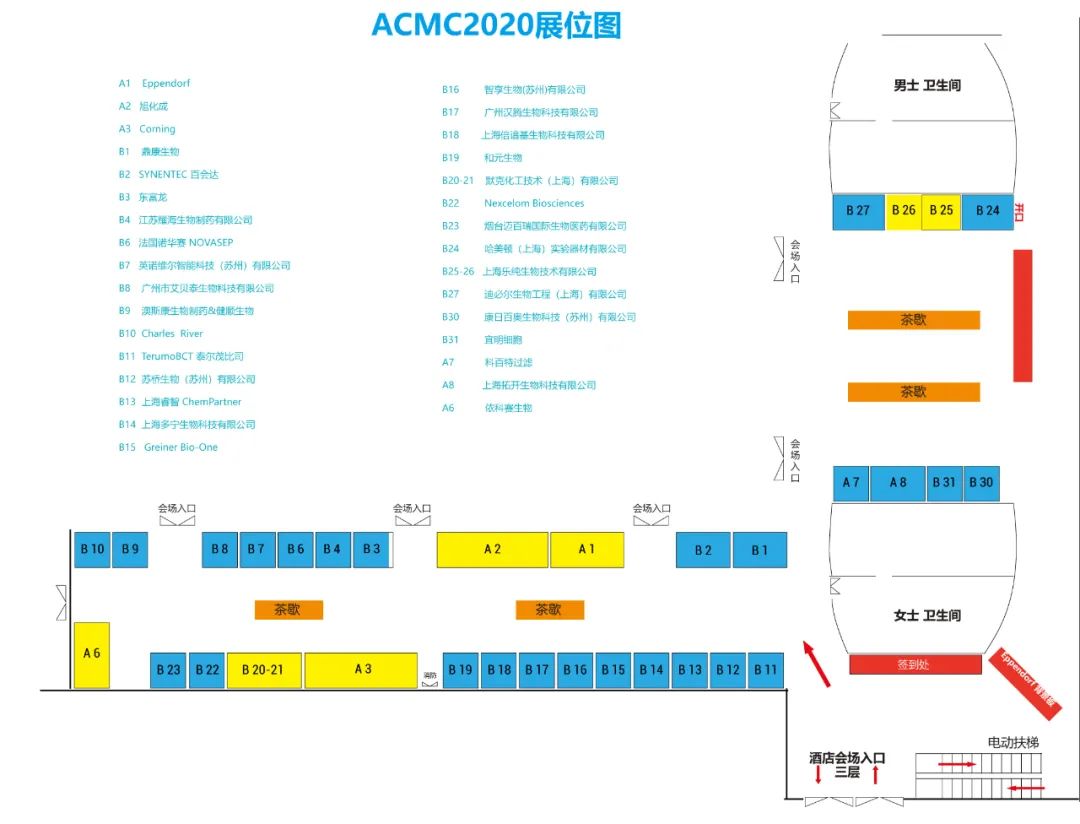
展区示意图






 个人中心
个人中心
 我是园区
我是园区




