
多次跨膜蛋白入核需要经过膜表面蛋白提取、从膜上脱落与跨膜运输多阶段步骤,在此过程中必须保护多个疏水跨膜结构域免受胞质亲水环境影响并保持蛋白空间构象。因此,传统观点认为跨膜蛋白以膜性结构局限定位在细胞膜/内膜中发挥生物学功能。
2021年6月7日、2022年2月23日Cell Research连续2篇文章发表了上海交通大学医学院附属第一人民医院王红霞团队关于四次跨膜蛋白入核信号调控的研究成果。


Tetraspanins四跨膜蛋白超家族(TM4SF)是一组广泛表达于真核细胞膜上的低分子量糖蛋白,在肿瘤侵袭转移、细胞黏附、增殖、组织分化和淋巴细胞激活等中发挥重要作用。哺乳动物tetraspanin家族包含33个成员,结构上包含4个高度疏水跨膜结构域,两侧为短N-末端和C-末端,通过与其他蛋白分子如整合素、粘附分子、免疫蛋白超家族、信号酶和T细胞受体等在质膜上组装成多聚体复合物、形成富含tetraspanin的微域(TEMs)发挥功能。
上海交通大学王红霞团队近年来围绕tetraspanins家族成员TSPAN8在肿瘤发生发展中的调控开展系列性研究。前期研究工作发现:乳腺癌中TSPAN8表达上调与治疗抵抗和不良预后相关。TSPAN8通过激活Hedgehog信号通路增强乳腺癌细胞干性、耐药形成、促进复发转移(Nat Commun 2019)。肿瘤进展过程中EGF/EGFR信号通路激活,可通过SOX9上调TSPAN8转录,促进肿瘤肝转移的发生(Oncogene 2021)。
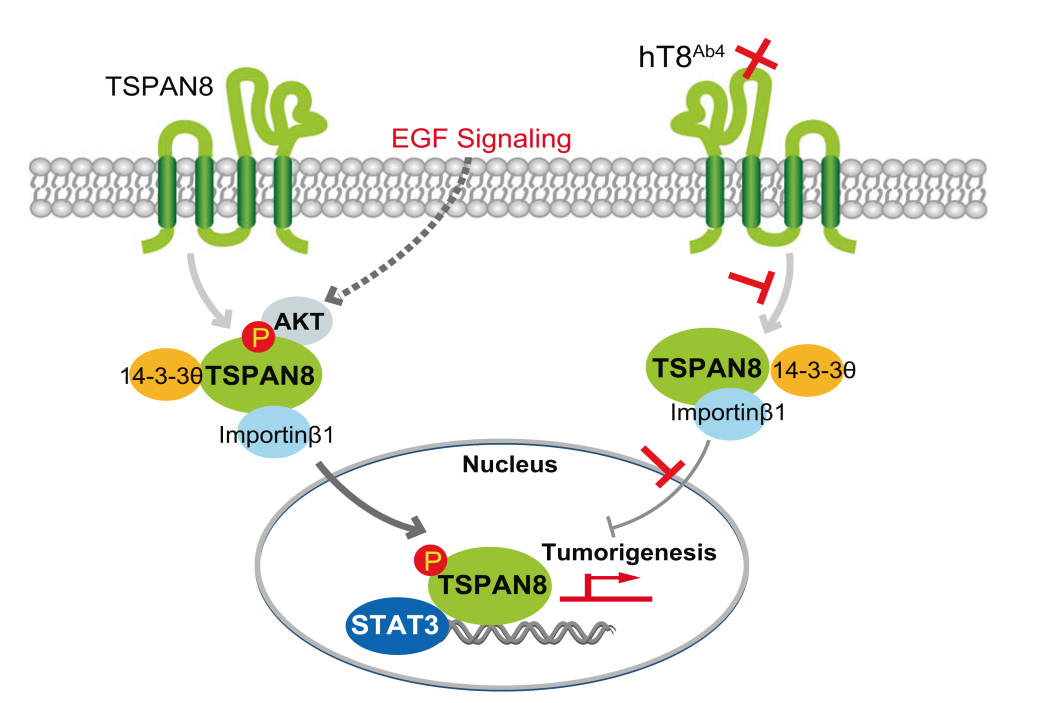
该团队在上述工作基础上,继续围绕相关调控机制及功能开展了深入研究,并于2021年6月Cell Research 发文报道,TSPAN8除定位于细胞膜/内膜外,可在细胞核内检测到。细胞核内TSPAN8信号以全长非膜性结构存在。以往认为跨膜蛋白以囊泡形式内吞从细胞膜上提取进入胞质/内膜,与此过程不同,非膜结构TSPAN8核转位的发生依赖于质膜上TSPAN8棕榈酰化修饰、TSPAN8/胆固醇复合体形成、膜上脱落、胞质中与14-3-3θ/importin-β结合通过核孔复合体转位入核的多阶段精细调控过程。
2022年2月23日,该团队于Cell Research 再次以全文形式报道了TSPAN8入核的信号调控机制。细胞质内TSPAN8/胆固醇复合体感受生长因子与代谢信号,AKT直接诱导TSPAN8 Ser129磷酸化,促进其与14-3-3θ/importin-β结合及核转运过程。转位入核后TSPAN8通过与STAT3相互作用,进而调控染色质重塑影响下游促癌基因的转录,如MYC、BCL2、MMP9等。EGFR-AKT-TSPAN8-STAT3轴在多种人类癌症中被发现过度激活,与侵袭性表型和不良预后相关。该项工作发现了传统跨膜蛋白生物学功能的复杂性,对TSPAN8核易位的分子机制以及核TSPAN8的功能提供了新的诠释,阐明了TSPAN8作为一个新的肿瘤治疗靶点的重要性。在此基础上,课题组进一步研发了靶向TSPAN8的人源化单克隆抗体,体内体外研究显示了良好的肿瘤治疗效果。
上述工作系统性揭示了多次跨膜蛋白分子调控复杂性,发现四次跨膜蛋白非膜性结构存在的形式,以及感受胞外生长因子刺激后、入核调控下游基因表达的新型信号调控模式,补充了人们对传统四次跨膜蛋白生物学功能局限在胞膜/胞质中的认识。
这一系列工作的通讯作者,王红霞为上海交通大学医学院附属第一人民医院肿瘤中心主任,博导。上海第一人民医院肿瘤中心(肿瘤学国家临床重点专科)是上海市三甲医院最早设立的肿瘤专科,下设肿瘤内科、肿瘤放疗科、肿瘤介入科、肿瘤分子诊断和生物治疗科,是医院高峰高原建设学科与重点发展的临床科室。目前共有医技人员60人,集肿瘤临床、科研和教学于一体,拥有丰富的临床资源、独立的组织标本库与临床数据库,拥有专属实验室,团队先后在Cell Res、Nat Cell Biol、Nat Commun、Sci Adv、PNAS等杂志发表研究论文300余篇。先后承担国家重大研究计划、国家“973”、“863”计划、重大国际合作等国家级课题30多项。
Tetraspanins(TSPANs)是一个细胞表面糖蛋白家族,参与细胞粘附、迁移和增殖等多种细胞功能。在TSPAN中,TSPAN8已被证明可调节各种人类癌症的进展,但其潜在机制尚不完全清楚。之前研究表明(Cell Research 2021),TSPAN8与胆固醇形成复合物,通过结合14-3-3θ和importin β,将其转移到细胞核。然而,关于核TSPAN8在癌症进展中的功能意义,以及调节TSPAN8核易位的信号通路仍不清楚。
在最近发表在Cell Research的研究中,Lu等人确定了TSPAN8介导的癌症进展的新机制,该机制涉及其在细胞核中的功能。为确定核TSPAN8在人类癌症中的潜在作用,他们首先在乳腺癌患者样本中验证了核TSPAN8的临床意义。TSPAN8的核定位与乳腺癌的各种侵袭性特征有关。此外,他们发现EGF刺激可诱导乳腺癌细胞中的TSPAN8核易位。
为进一步剖析EGF-EGFR介导的TSPAN8核易位的潜在机制,他们筛选了EGF增强的TASPAN8结合蛋白,并确定AKT和STAT3可以与TSPAN8相互作用,并且EGF刺激增强了这种关联。作为对EGFR激活的反应,AKT结合并磷酸化S129处的TSPAN8。与野生型TSPN8相比,磷酸化模拟TSPAN8 S129D突变体显示出增加的核定位,并促进细胞增殖和集落形成,这表明AKT通过S129磷酸化调节TSPAN8的核定位及其功能。此外,STAT3-TSPAN8相互作用也依赖于TSPAN8 S129磷酸化。有趣的是,TSPAN8与细胞核中的STAT3相互作用调节各种靶基因的转录,如MYC、BCL2和MMP9。在乳腺癌异种移植小鼠模型中,S129磷酸化和STAT3在TSPAN8介导的肿瘤进展中的作用也得到了证实。
最后,他们开发了一种针对TSPAN8的治疗性单克隆抗体,并证明该抗体在体外可阻止癌细胞增殖,在体内可阻止肿瘤发展。总之,这项研究确定了TSPAN8在人类乳腺癌中的新作用,并证明了其对乳腺癌的治疗潜力。显而易见的,进一步的临床前和临床研究有望指导未来的临床应用!此外,由于TSPAN8靶点与STAT3靶点重叠约40%,因此有必要进一步研究TSPAN8如何调控细胞核中的其他靶基因及其在癌症中的作用。
Lu等人的这项研究与之前发表在Nature上的一篇文章Xu等人(Nature. 2020;580(7804):530-535)之间有着有趣的相似性,这篇文章证明AKT在人类肝细胞癌(HCC)细胞中响应对IGF1刺激的反应,能结合并磷酸化胞浆中的磷酸烯醇式丙酮酸羧激酶1(PCK1),PCK1是糖异生的限速酶。磷酸化的PCK1随后将底物转换为磷酸化INSIG1/2,后者将胆固醇从INSIG1/2复合物中解离,以促进SCAP从内质网释放,从而激活细胞核中的SREBP1新生脂肪生成途径,并增强肿瘤细胞的增殖。
与AKT-PCK1介导的SREBP1核易位不同,胆固醇结合似乎对TSPAN8的核易位很重要。这是一个重要的研究方向,进一步研究AKT介导的TSPAN8的功能改变如何与STAT3介导的转录之外的癌症进展有关,将是一件有趣的事情!另一个关注点是,已知EGFR能够通过膜结合囊泡相关机制,即INTERNET,转移到细胞核中(Am J Cancer Res 2015; 5(10):2944-2958; J Biol. Chem. 2012; 287(20):16869-16879.). 因此,EGF/EGFR似乎有两种机制将信息从细胞表面传递到细胞核。EGFR如何以及何时选择不同的途径来触发核功能将是一个值得进一步探索的有趣且重要的领域。
Tetraspanins (TSPANs) are a family of cell-surface glycoproteins involved in a variety of cellular functions such as cell adhesion, migration and proliferation. Among TSPANs, TSPAN8 has been shown to regulate the progression of various human cancer, but the underlying mechanism is not fully understood. In addition, it was previously shown that TSPAN8 forms a complex with cholesterol, which translocates to the nucleus by binding to 14-3-3θ and importin β. However, the functional significance of nuclear TSPAN8 in cancer progression and the signaling pathways regulating the nuclear translocation of TSPAN8 remained elusive.
In the paper recently published in Cell Research, Lu et al., identified the novel mechanism of TSPAN8-mediated cancer progression that involves its function in the nucleus. To determine the potential role of nuclear TSPAN8 in human cancer, they first verified the clinical significance of nuclear TSPAN8 in breast cancer patient samples. Nuclear localization of TSPAN8 is associated with various aggressive features of breast cancer. Moreover, they found that the EGF stimulation induces TSPAN8 nuclear translocation in breast cancer cells.
To further dissect the underlying mechanism of the EGF-EGFR-mediated nuclear translocation of TSPAN8, they screened the TASPAN8-binding proteins enhanced by EGF and identified that AKT and STAT3 can interact with TSPAN8, and the association is enhanced by EGF stimulation. In response to EGFR activation, AKT binds to and phosphorylates TSPAN8 at S129. Phospho-mimic TSPAN8 S129D mutant shows increased nuclear localization, and promotes cell proliferation and colony formation compared to wild type TSAPN8, suggesting that AKT regulates TSPAN8 nuclear localization and its function through S129 phosphorylation.
Moreover, STAT3-TSPAN8 interaction is also dependent on TSPAN8 S129 phosphorylation. Intriguingly, TSPAN8 interacts with STAT3 in the nucleus and the complex regulates the transcription of various target genes such as MYC, BCL2 and MMP9. In breast cancer xenograft mouse models, the role of the S129 phosphorylation and STAT3 in TASPAN8-mediated tumor progression was also verified.
Finally, they developed a therapeutic monoclonal antibody against TSPAN8 and demonstrated that the antibody blocks cancer cell proliferation in vitro and tumor development in vivo. Altogether, this study identified the novel role of TASPAN8 in human breast cancer and demonstrated its therapeutic potential for breast cancer. Obviously further preclinical and clinical studies are expected to lead to the future clinical application. Moreover, because the TSPAN8 targets overlaps about 40% of STAT3 targets, additional research is warranted to address how TSPAN8 controls other target genes in the nucleus and their roles in cancer.
There are interesting similarity between the article from Lu et al in Cell research and a previous article published in Nature, Xu et al. (Nature. 2020 ;580(7804):530-535) which demonstrated that AKT binds to and phosphorylates cytosolic phosphoenolpyruvate carboxykinase 1 (PCK1), the rate-limiting enzyme of gluconeogenesis, in responding to stimulation of IGF1 in human hepatocellular carcinoma (HCC) cells. The phosphorylated PCK1 subsequently switches the substrate to phosphorylate INSIG1/2, which dissociates cholesterol from INSIG1/2 complex to promote the release of SCAP from the endoplasmic reticulum to activate the SREBP1 de novo lipogenesis pathway in the nucleus and enhance the proliferation of tumor cells. Different from the AKT-PCK1-mediated SREBP1 nuclear translocation, cholesterol-binding seems to be important for the nuclear translocation of TSPAN8. It would be interesting to further study how the AKT-mediated functional alteration of TSPAN8 contributes to cancer progression other than STAT3-mediated transcription. Another interesting point is that EGFR is known to be able to translocate into nucleus through a membrane-bound vesicle-associated mechanism, INTERNET ( Am J Cancer Res 2015;5(10):2944-2958 ; J Biol. Chem. 2012 ; 287(20):16869-16879.). Thus, EGF/EGFR seems to have two types of mechanisms to pass the messages from cell surface to the nucleus. How and when EGFR chooses different pathways to trigger nuclear functions will be an interesting and important area to explore further.
课题组长期招聘博士后,欢迎有志青年加盟!

转载须知
【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经允许禁止转载,作者拥有所有法定权利,违者必究。




 个人中心
个人中心
 我是园区
我是园区




