华南农业大学黄耀伟-浙江大学徐平龙课题组在冠状病毒与宿主HSP90互作机理方面取得新进展
收藏
关键词:
病毒机理进展
资讯来源:生物制品圈 + 订阅账号
发布时间:
2023-04-15
 热休克蛋白(HSP90)是一种分子伴侣蛋白,可以帮助其它蛋白质正确折叠并保持其稳定性。已有实验结果表明,在体外条件下使用特定的HSP90抑制剂可以有效抑制SARS-CoV-2的感染,但其作用机制未明。近日,华南农业大学兽医学院/岭南实验室黄耀伟教授与浙江大学生命科学研究院徐平龙教授合作,在Journal of Biological Chemistry上在线发表题为“Heat shock protein 90 facilitates SARS-CoV-2 structural protein-mediated virion assembly and promotes virus-induced pyroptosis”的文章
https://www.sciencedirect.com/science/article/pii/S0021925823003101),进一步阐述了新冠病毒与HSP90的互作机理。
热休克蛋白(HSP90)是一种分子伴侣蛋白,可以帮助其它蛋白质正确折叠并保持其稳定性。已有实验结果表明,在体外条件下使用特定的HSP90抑制剂可以有效抑制SARS-CoV-2的感染,但其作用机制未明。近日,华南农业大学兽医学院/岭南实验室黄耀伟教授与浙江大学生命科学研究院徐平龙教授合作,在Journal of Biological Chemistry上在线发表题为“Heat shock protein 90 facilitates SARS-CoV-2 structural protein-mediated virion assembly and promotes virus-induced pyroptosis”的文章
https://www.sciencedirect.com/science/article/pii/S0021925823003101),进一步阐述了新冠病毒与HSP90的互作机理。

本研究系统检测了HSP90与26种SARS-CoV-2病毒蛋白的互作情况,发现5个病毒蛋白为HSP90的客户蛋白,包括核衣壳蛋白(N)、膜蛋白(M)、以及辅助Orf3、Orf7a和Orf7b蛋白,均能与Hsp90的两个亚型(Hsp90α,Hsp90β)互作,并且这些蛋白的稳定性通过Hsp90β调节。使用病毒样颗粒组装实验和SARS-CoV-2 GFP/ΔN类病毒系统(清华大学丁强教授实验室建立)探讨了靶向HSP90在新冠病毒感染各个生命周期阶段所起的作用,表明Hsp90主要影响新冠病毒结构蛋白M与N的稳定性,进而影响了病毒颗粒的组装。此外,靶向Hsp90抑制SARS-CoV-2引起细胞焦亡,也抑制类病毒仓鼠感染模型中产生的炎症反应和肺损伤。这些研究结果共同表明了在SARS-CoV-2感染期间或可采用靶向Hsp90治疗的机理:一方面通过抑制Hsp90对结构蛋白的分子伴侣作用直接抑制病毒颗粒的产生,另一方面通过降低SARS-CoV-2引起的细胞焦亡,从而减轻炎性损伤
导致的重症。
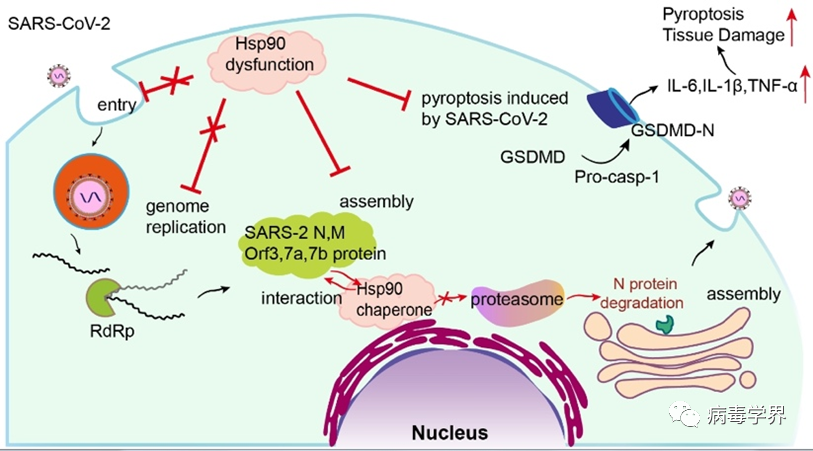
由于更早的研究报道Hsp90与中东呼吸综合征冠状病毒MERS-CoV 的N蛋白也存在相互作用,这可能表明Hsp90是其它冠状病毒N蛋白的广谱分子伴侣。因此黄耀伟课题组同时研究了HSP90在四种猪肠道冠状病毒(猪流行性腹泻病毒PEDV,猪丁型冠状病毒PDCoV,猪传染性胃肠炎病毒TGEV以及猪急性腹泻综合征冠状病毒SADS-CoV)中的作用,相关研究近日发表在Virus Research期刊上。题目为“Role of heat shock protein 90 as an antiviral target for swine enteric coronaviruses”(链接:https://www.sciencedirect.com/science/article/pii/S0168170223000655)。研究结果同样显示猪源Hsp90与PEDV,PDCoV,TGEV以及SADS-CoV的N蛋白互作并影响其蛋白稳态,尽管这些N蛋白的氨基酸差异较大。以SADS-CoV感染猪肠道类器官及人单核细胞THP-1为研究模型,也验证了靶向Hsp90抑制SADS-CoV感染引起的细胞焦亡。因此,靶向HSP90可以广谱抑制冠状病毒的感染,其互作的共同靶点为N蛋白及细胞焦亡通路。
黄耀伟教授、徐平龙教授为JBC论文的共同通讯作者。博士生赵壮壮、博士后徐令东及张飞为JBC论文的共同第一作者。研究工作得到岭南实验室科研项目、国家自然科学基金重大研究计划的资助。

 热休克蛋白(HSP90)是一种分子伴侣蛋白,可以帮助其它蛋白质正确折叠并保持其稳定性。已有实验结果表明,在体外条件下使用特定的HSP90抑制剂可以有效抑制SARS-CoV-2的感染,但其作用机制未明。近日,华南农业大学兽医学院/岭南实验室黄耀伟教授与浙江大学生命科学研究院徐平龙教授合作,在Journal of Biological Chemistry上在线发表题为“Heat shock protein 90 facilitates SARS-CoV-2 structural protein-mediated virion assembly and promotes virus-induced pyroptosis”的文章
https://www.sciencedirect.com/science/article/pii/S0021925823003101),进一步阐述了新冠病毒与HSP90的互作机理。
热休克蛋白(HSP90)是一种分子伴侣蛋白,可以帮助其它蛋白质正确折叠并保持其稳定性。已有实验结果表明,在体外条件下使用特定的HSP90抑制剂可以有效抑制SARS-CoV-2的感染,但其作用机制未明。近日,华南农业大学兽医学院/岭南实验室黄耀伟教授与浙江大学生命科学研究院徐平龙教授合作,在Journal of Biological Chemistry上在线发表题为“Heat shock protein 90 facilitates SARS-CoV-2 structural protein-mediated virion assembly and promotes virus-induced pyroptosis”的文章
https://www.sciencedirect.com/science/article/pii/S0021925823003101),进一步阐述了新冠病毒与HSP90的互作机理。






 个人中心
个人中心
 我是园区
我是园区




