
关注我们
药谷消息
8月25日,张江科学城创新药企业来凯医药宣布,国家药品监督管理局药品审评中心(CDE)于8月17日批准其处于临床开发阶段的1类候选新药afuresertib(LAE002)联合抗雌激素药物氟维司群,在标准治疗失败的局部晚期或转移性在激素受体阳性/人表皮生长因子2受体阴性乳腺癌患者(下简称HR+/HER2-)的Ib/III期临床试验研究。
据悉,这是继6月19日获得美国食品和药物管理局(FDA)临床批件之后,在国内获得的临床批件。至此,这一全球多中心临床研究比原计划提前一个月在中美两国同步启动。此次快速批准也意味着:afuresertib联合氟维司群联合治疗在1b期研究中获得了可靠的安全性数据后,可尽快展开III期全球注册研究。

凯医药成立于 2016 年 12 月,是一家活跃于中国“张江药谷”和美国新泽西的一家医药新锐公司,专注于肿瘤与肝病领域的突破性新药研发。目前,该公司采取“双线并举”的新药开发策略,一方面通过引进已经有临床验证(Proof of Concept)结果的新药项目持续丰富自身产品管线,目前公司已经获得诺华公司授予 4 项候选新药的全球独家授权;同时,公司自主开发的创新药也即将进入临床开发阶段。
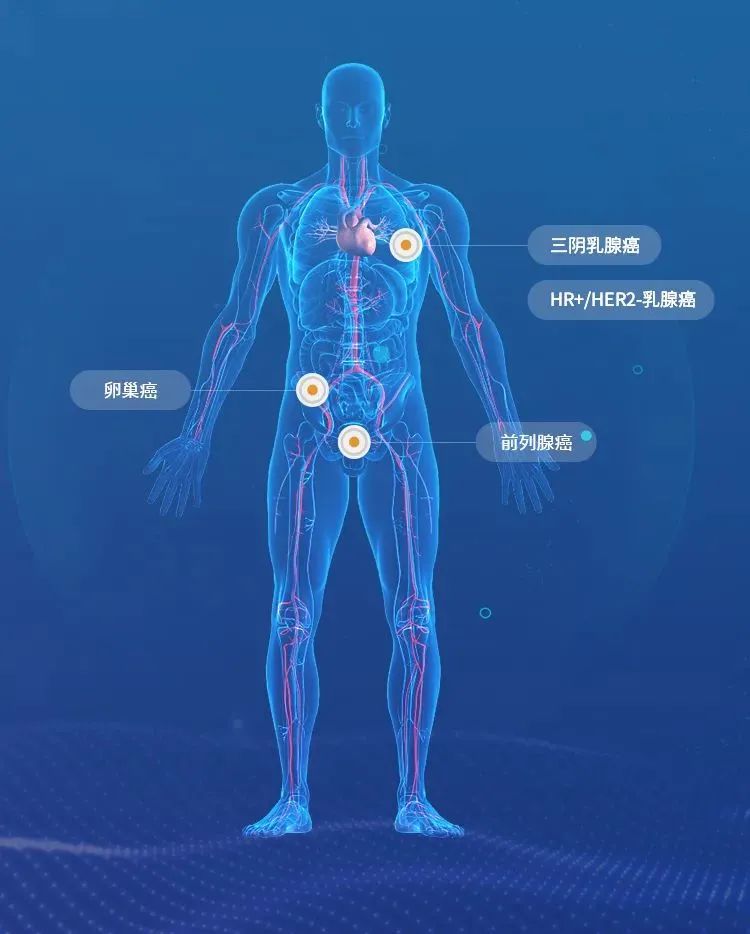
Afuresertib(LAE002)是来凯医药从诺华公司引进全球独家权益、已有临床验证结果(Proof of Concept)的候选新药,属于新一代小分子泛AKT激酶强效抑制剂。目前afuresertib已在全球收获4个癌种的临床研究,覆盖卵巢癌、前列腺癌、三阴乳腺癌、HR+/HER2-乳腺癌。
它与来凯医药旗下的另一款候选药物——口服小分子泛AKT激酶抑制剂Uprosertib(LAE003)已经在包括卵巢癌、胃癌、多发性骨髓瘤、黑色素瘤等多种癌症适应症完成了20多项临床I/II期研究,其临床疗效和耐受安全性已得到初步临床验证(Proof-of-Concept)。
Afuresertib(LAE002)正在全球展开两项II期和两项I期临床研究,其中针对卵巢癌的全球随机、开放、多中心 II 期注册临床研究(PROFECTA-II),是泛AKT激酶抑制剂在全球首个针对卵巢癌的注册临床研究。

乳腺癌是全球女性中最常见的癌症。在中国所有乳腺癌患者中,约62%属于HR+/HER2-1 ,美国患者中这一类分子亚型比例高达68% 2。
尽管大多数此类乳腺癌患者最初可从一/二线治疗的抗激素疗法及CDK4/6 抑制剂或者化疗中获益,但一段时间后,大部分肿瘤患者可能对上述治疗产生耐药。肿瘤耐药以后的治疗选择一直是乳腺癌各种临床研究致力解决的难点之一。

“HR+/HER2-在乳腺癌患者中占比最大,抗激素治疗及CDK4/6抑制剂耐药以后的治疗是目前最亟需解决的多种未满足的医疗需求之一。这也是显著提高乳腺癌患者治疗效果及改善生活质量的最关键一环。
Afuresertib多种联合治疗目前已在多种癌症耐药患者的临床试验中,初步显示出抗肿瘤疗效及良好的安全性,尤其是女性特有的卵巢癌和乳腺癌。
我们期待这些联合治疗能够给患者带来新的希望,也让医生在面对这些难治的肿瘤耐药患者时有更多更好的选择。”


“此次临床批件比原计划提前一个月获批,充分显示了中国国家药品监督管理局的高效,以及对于乳腺癌耐药以后新一代治疗新药的期待和重视。同时,也凸显了来凯医药中美团队的强大执行力,有望使乳腺癌患者更早受益于新药。
在AKT酶抑制剂全球赛道上,来凯医药目前位于第一梯队。我们正在加速推进多项临床试验,希望afuresertib有实力摘下全球‘同类首个’(first-in-class)的金牌。”
[1] Li, Z.S., et al., Breast cancer subtypes and survival in chinese women with operable primary breast cancer. Chin J Cancer Res, 2011. 23(2): p. 134-9.
[2] SEER Cancer Stat Facts: Female Breast Cancer Subtypes. National Cancer Institute. Bethesda, MD. Available from: https://seer.cancer.gov/statfacts/html/breast-subtypes.html
本文消息来源于企业官微





 个人中心
个人中心
 我是园区
我是园区




