
2021年4月14日,南科大生命科学学院黄鸿达副教授团队和丹麦哥本哈根大学Anja Groth教授团队等合作,在Molecular Cell杂志在线发表题为DNAJC9 integrates heat shock molecular chaperones into the histone chaperone network的研究论文。该研究鉴定了一个全新的组蛋白伴侣DNAJC9,并揭示了其调控组蛋白H3-H4代谢过程的分子机理。

该合作团队通过他们前期的工作(MCM2在复制叉中调控旧组蛋白H3-H4回收和组装的分子机理(NSMB. 2015, 22(8): 618-626.)。TONSL在复制过程识别新组蛋白H3-H4以及标记复制后染色质的分子机理(Nature. 2016, 534(7609): 714-718)),发现不同的组蛋白伴侣往往通过组蛋白H3-H4介导的相互作用形成“共伴侣”复合物(Co-chaperone complexes;Nat Rev MCB. 2017, 18(3): 141-158.)。在“共伴侣”复合物想法的驱动下,团队利用MCM2和TONSL不与组蛋白H3-H4结合的突变体设计了一种基于SILAC-MS的筛选方法(图1),并成功地筛选到多个MCM2或者TONSL的共伴侣因子。其中新筛选到的DNAJC9和MCM2、TONSL均可以形成共伴侣复合物。接着他们证明DNAJC9在体外具有组蛋白伴侣活性,是一个全新的组蛋白伴侣。并发现在DNAJC9的C端具有一个组蛋白结合结构域(HBD),通过高分辨率的晶体结构揭示了其HBD结构域如何识别组蛋白H3-H4二聚体,并与MCM2的HBD结构域形成共伴侣复合物 (图1)。
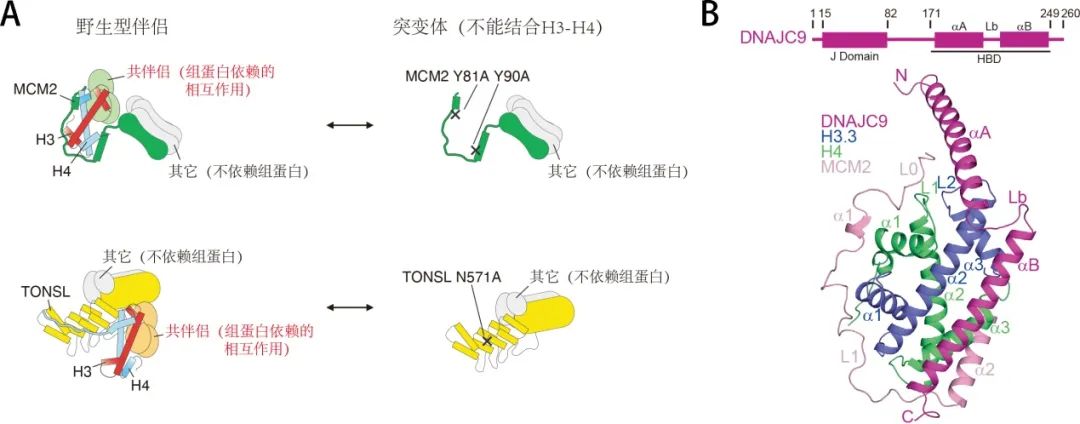
DNAJC9在它的N端具有一个典型的J结构域,提示它可以招募热激蛋白HSP70催化蛋白折叠。基于结构分析和设计蛋白突变体,作者在细胞中做了一系列组学实验,结果表明DNAJC9可以招募热激蛋白HSP7C:(1)对新合成的组蛋白H3和H4进行折叠,并调控H3-H4二聚体进入下游的组蛋白供应链(Histone supply pathway);(2)在复制和转录过程中,帮助和其它因子非特异性(或者错误)相互作用的组蛋白或者变性的组蛋白中间体重新折叠进入组蛋白供应链和核小体组装。
因此,该研究揭示了DNAJC9将组蛋白伴侣(Histone chaperone)和分子伴侣(Molecular chaperone)两套系统密切结合在一起来调控组蛋白H3-H4代谢过程的分子机制。
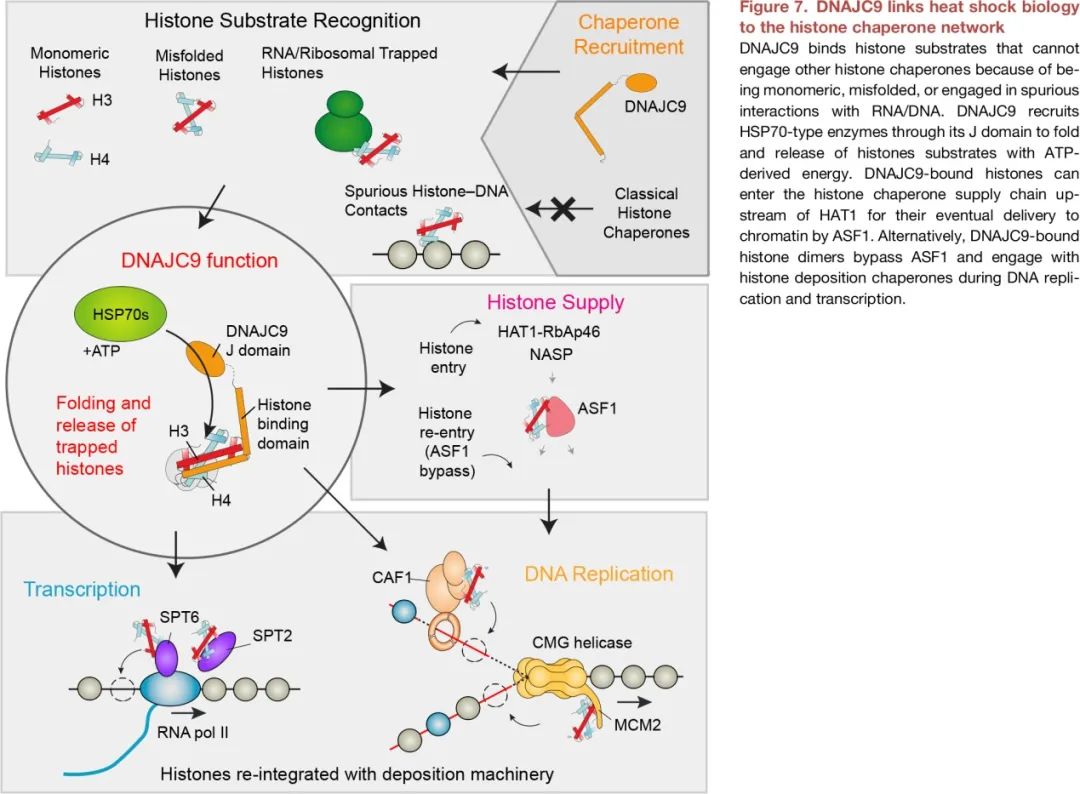
图2. DNAJC9作用的分子机理示意图。
据悉Groth研究组的Colin Hammond博士和黄鸿达研究组的鲍洪宇博士为本论文的共同第一作者。Groth教授和黄鸿达副教授,以及斯隆凯特琳癌症研究中心的Dinshaw Patel教授为本论文的共同通讯作者。
原文链接:
https://www.cell.com/molecular-cell/fulltext/S1097-2765(21)00262-8
转载须知
【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经允许禁止转载,作者拥有所有法定权利,违者必究。




 个人中心
个人中心
 我是园区
我是园区




