您还不是认证园区!
赶快前去认证园区吧!

9 月 28 日,泽璟制药宣布,其自主研发的 1 类新药盐酸杰克替尼片已向国家药品监督管理局(NMPA)递交新药上市申请(NDA),目前等待正式受理中。在获得受理之后,杰克替尼将成为国产首个申请上市的 JAK 抑制剂。
本次递交新药上市申请的适应症是用于治疗中、高危骨髓纤维化,包括原发性骨髓纤维化(PMF)、真性红细胞增多症后骨髓纤维化(Post-PV-MF)和原发性血小板增多症后骨髓纤维化(Post-ET-MF),这是盐酸杰克替尼片首个递交新药上市申请的临床适应症。
盐酸杰克替尼是泽璟制药自主研发、拥有知识产权的一种新型 JAK 抑制剂类药物,属于 1 类新药。杰克替尼对 Janus 激酶包括 JAK1、JAK2、JAK3 和 TYK2 具有显著的抑制作用,且对 JAK2 和 TYK2 的抑制作用最强。另外,杰克替尼还可以通过抑制激活素受体 1(ACVR1)活性降低铁调素转录,改善铁代谢失衡,增加血红蛋白,降低骨髓纤维化患者贫血发生率和减少输血依赖。
《一项随机、双盲、双模拟、平行对照、多中心评价盐酸杰克替尼片对照羟基脲片治疗中高危骨髓纤维化患者的有效性和安全性的 III 期临床试验》(方案编号:ZGJAK016),在浙江大学医学院附属第一医院和中国医学科学院血液病医院等 38 家医院开展,独立数据监查委员会(IDMC)对该项试验的期中分析数据进行审核后,判定本次期中分析结果达到了方案预设的主要疗效终点。有关该项临床试验的详细数据,将在后续相关学术会议上公布。
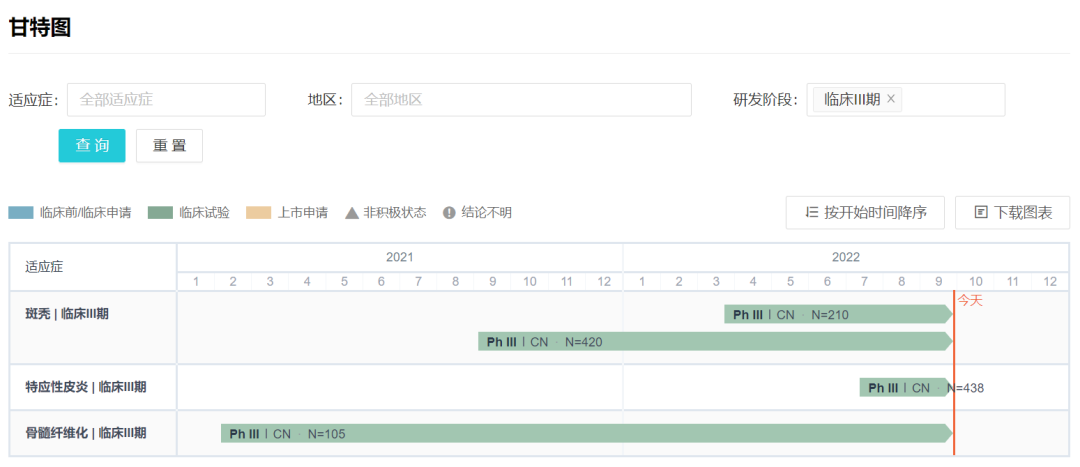
除本次申报上市的适应症之外,据 Insight 数据库显示,杰克替尼还有两项适应症处于 III 期临床开发中:特应性皮炎、斑秃。
杰克替尼 III 期临床布局



 个人中心
个人中心
 我是园区
我是园区




