
世界范围内育龄人口的不孕不育率约10-15%,并呈逐年升高趋势。减数分裂异常导致的配子发生障碍或质量低下是引发不孕不育的重要原因。减数分裂启动及进程中同源染色体配对、联会和重组等一系列特殊的细胞学事件,是保证减数分裂顺利完成,形成正常配子的关键。因此,对减数分裂中分子调控机制的研究,一直是当前遗传学领域的研究热点。
RNA结合蛋白
(RNA-binding proteins,
RBPs
)
是一类可识别和结合特定 RNA 序列或结构元件的蛋白质,其主要通过调控mRNA的翻译、稳定性及可变剪切等,参与基因的转录后调控过程
【1】
,研究证实多个RNA结合蛋白家族成员在配子发生过程起着重要作用
【2,3】
。2020年,中国科学院动物研究所刘光慧、曲静课题组在Cell杂志上报道,RBM46在食蟹猴卵巢的卵母细胞中呈特异性表达,并提示可将其作为卵细胞的新标志基因
【4】
。但RBM46在配子生成过程中的靶分子及调控机制仍不清楚。近期,陈伟仪、Russ P. Carstens及叶岚三个课题组几乎同时对RBM46在配子发生中的作用及分子机制进行了报道。2022年8月26日,南京医科大学叶岚课题组报道,RBM46作为YTHDC2蛋白复合物成员,可通过靶向RNA底物,在减数分裂起始阶段发挥沉默有丝分裂相关转录本的作用,文章发表在Science Advances杂志上
【5】
。9月21日,美国宾夕法尼亚大学Russ P. Carstens课题组在PLoS Genetics杂志上报道,RBM46在小鼠精原干细胞的分化中也发挥重要作用
【6】
。
近日,香港中文大学-山东大学生殖遗传联合实验室陈伟仪教授、陈子江教授和刘洪彬教授,以及中科院生物物理研究所薛愿超研究员的团队紧密合作,共同在Protein & Cell杂志上在线发表了文章
RBM46 is essential for gametogenesis and functions in post-transcriptional roles affecting meiotic cohesin subunits
。该研究发现
在减数分裂起始过程中,RBM46对于联会复合体的正常形成是必需的,研究证实了RBM46在减数分裂起始过程中通过与编码粘连蛋白复合体亚基(cohesin complex subunits)的mRNAs中3'UTR区域的特定序列结合,调控粘连蛋白进行正常翻译,从而确保减数分裂联会过程的正常进行。
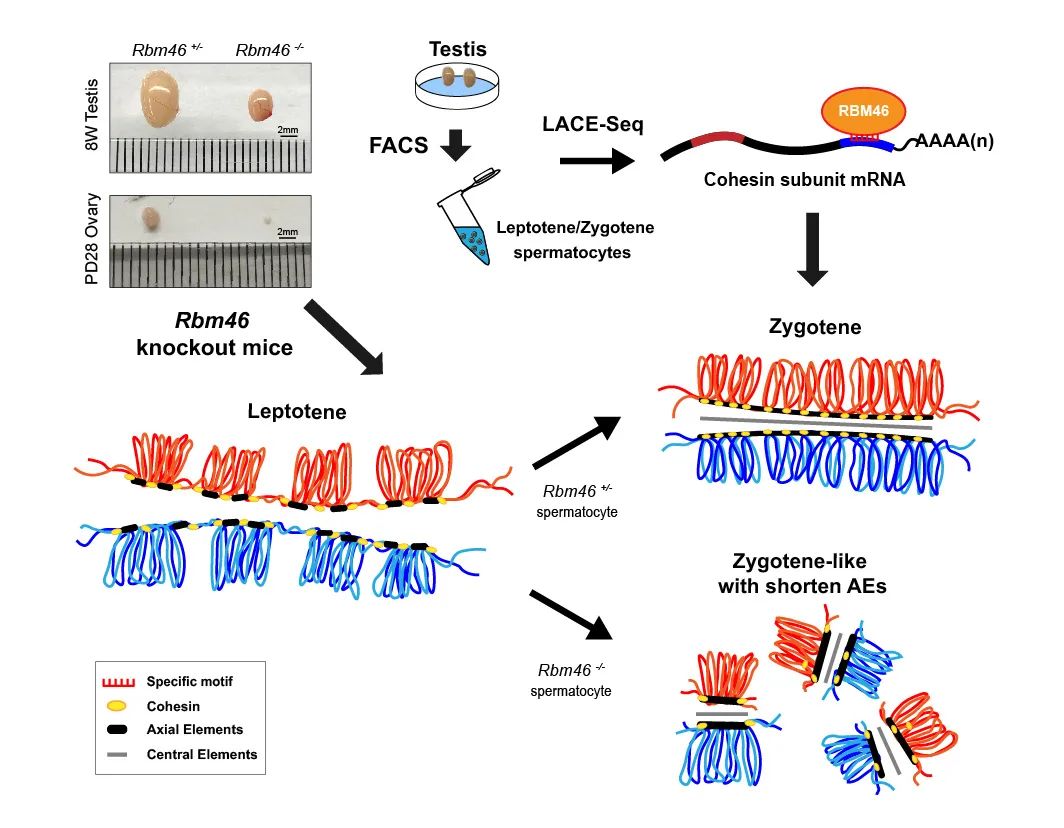
RBM46在生殖细胞中特异性表达并定位于细胞质中,为探究RBM46在配子发生中的作用,研究团队构建了Rbm46基因敲除小鼠,Rbm46敲除后雄性小鼠睾丸无精子生成,曲细精管出现空管化,雌鼠出生后卵巢中卵母细胞逐渐丢失,表现为雌雄小鼠不孕不育。染色体铺片证实雌雄配子均阻滞在减数分裂细线期
(leptotene)
,出现染色体轴向原件
(axial elements)
缩短及联会复合体形成发生异常,表型与粘连蛋白亚基Stag3 和 Rad21L等敲除小鼠表型类似
【7】
。
粘连蛋白
(cohesin)
是在姐妹染色单体凝聚过程中一系列重要的多亚基复合体,在细胞分裂过程中通过形成环状结构以将姐妹染色单体保持在一起,减数分裂过程中粘连蛋白在染色体轴向元件组装、DNA双链断裂和染色体联会等相关染色体事件中都具有的特定功能。在RBM46敲除小鼠睾丸中我们观察到粘连蛋白亚基SMC3、RAD21和STAG3翻译水平均明显降低,并且染色体定位发生改变。
为解析RBM46在减数分裂中靶分子及其调控机制,研究团队借助LACE-seq
(Linear amplification of complementary DNA ends and sequencing)
【8】
等技术,对细线期及偶线期的小鼠精母细胞中RBM46的靶标及结合位点进行了解析及验证。生物信息学分析结果发现RBM46主要结合于目标mRNA的3'UTR区域,并特异性识别“GCCUAU/GUUCGA”基序。通过RIP-qPCR验证,粘连蛋白亚基Stag3、Rad21、Smc3 和 Smc1b均为RBM46的目标mRNA,而体外双荧光素酶报告系统实验进一步证实了RBM46特异性结合4个粘连蛋白mRNA的3'UTR区域的“GCCUAU/GUUCGA”基序而调控翻译。
综上所述,本研究
发现RBM46通过结合3'UTR区域,调控减数分裂过程中粘连蛋白复合体亚基
(cohesin complex subunits)
的翻译,从而确保减数分裂联会过程的正常进行。
该研究为减数分裂过程调控分子机制进行了研究和完善,同时也为原发性不孕不育患者提供了新的机制解释。
香港中文大学-山东大学生殖遗传联合实验室博士后吕跃、高级研究员路钢、博士生蔡玉玲和中国科学院生物物理研究所博士生苏瑞宝为共同第一作者,香港中文大学陈伟仪教授、山东大学陈子江教授和刘
洪彬教授、中国科学院生物物理研究所薛愿超研究员为共同通讯作者。
香港中文大学-山东大学生殖遗传联合实验室陈伟仪副校长(香港中文大学)和陈子江院士(山东大学),联合招收博士后研究员,欢迎对生殖与发育、男科学、妇幼健康、遗传学、生物信息等方向感兴趣的青年才俊加盟(http://www.sduivf.sdu.edu.cn/info/1031/1289.htm)。
原文链接:
https://doi.org/10.1093/procel/pwac040
制版人:十一
1. Gerstberger S, Hafner M, Tuschl T. A census of human RNA-binding proteins. Nat Rev Genet. 2014; 15: 829-845.
2. Sutherland JM, Siddall NA, Hime GR, et al. RNA binding proteins in spermatogenesis: an in depth focus on the Musashi family. Asian J Androl. 2015; 17: 529-536.
3. Rosario R, Childs AJ, Anderson RA. RNA-binding proteins in human oogenesis: Balancing differentiation and self-renewal in the female fetal germline. Stem Cell Res. 2017; 21: 193-201.
4. Wang S, Zheng YX, Li JY, et al. Single-Cell Transcriptomic Atlas of Primate Ovarian Aging. Cell. 2020; 180: 585-600.e519.
5. Qian B, Li Y, Yan R, et al. RNA binding protein RBM46 regulates mitotic-to-meiotic transition in spermatogenesis. Sci Adv. 2022; 8: eabq2945.
6. Peart NJ, Johnson TA, Lee S, et al. The germ cell-specific RNA binding protein RBM46 is essential for spermatogonial differentiation in mice. PLoS Genet. 2022; 18: e1010416.
7. Llano E, Herran Y, Garcia-Tunon I, et al. Meiotic cohesin complexes are essential for the formation of the axial element in mice. J Cell Biol. 2012; 197: 877-885.
8. Su RB, Fan LH, Cao CC, et al. Global profiling of RNA-binding protein target sites by LACE-seq. Nature Cell Biology. 2021; 23: 664-675.

【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经作者的允许禁止转载,作者拥有所有法定权利,违者必究。







 药选址
药选址






