
据Insight 数据库 统计,上周(10 月 10 日 - 10 月 16 日)全球共有 64 款创新药(含改良新)研发进度推进到了新阶段,其中 17 款首次申报临床,10 款首次获批临床。
下面,Insight 将分别摘取国内外部分重点项目做介绍。

国内创新药进展
国内方面,本周共有 36 款创新药(含改良新)研发进度推进到了新的阶段,其中,申报临床 17 款,获批临床 8 款,首次公示临床试验的有 6 款。
上周国内首次启动临床的 6 款创新药(含改良新)
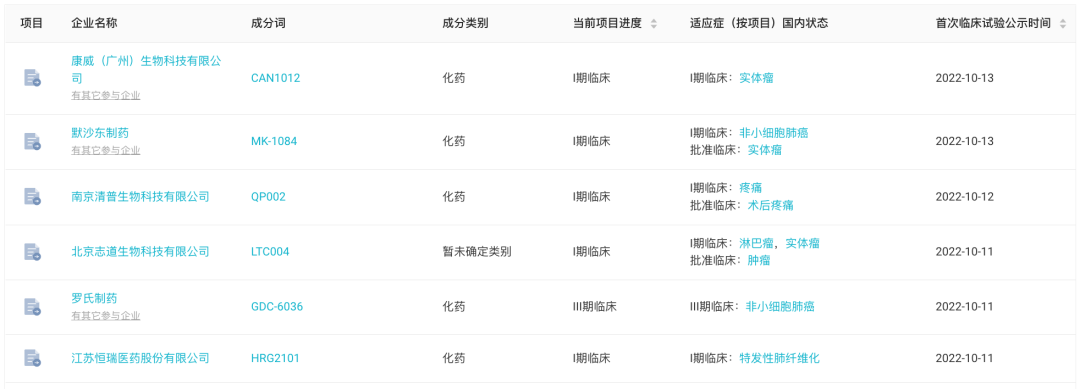
来自:Insight 数据库网页版(http://db.dxy.cn/v5/home/)
国内新药首次获批上市
1、协和麒麟:莫格利珠单抗获批上市
10 月 14 日,NMPA 发布最新批件,批准协和麒麟的 First-in-Class 新药莫格利珠单抗在中国上市。
这款 CCR4 抑制剂用于既往接受过至少一次全身性治疗的蕈样肉芽肿(MF)或 Sézary 综合征 (SS) 成年患者的治疗,去年 7 月申报上市并被 CDE 纳入优先审评。>>点此回顾受理号审评历程
莫格利珠单抗注射液(Mogamulizumab)是抗 CC 趋化因子受体 4 (CCR4) 单克隆抗体,是由协和发酵株式会社研发。2012 年首次在日本获批用于治疗成人 T 细胞白血病/淋巴瘤(ATLL);2014 年在日本获批用于外周 T 细胞淋巴瘤( PTCL)和皮肤 T 细胞淋巴瘤 (CTCL) 。2018 年 8 月 8 日获 FDA 批准用于至少接受过一次全身治疗后复发或难治性蕈样真菌病 (MF) 或 Sézary 综合征 (SS) 的成年患者。
蕈样真菌病 (MF) 和 Sézary 综合征 (SS) 是不常见的慢性 T 细胞淋巴瘤,主要侵犯皮肤,偶尔侵犯淋巴结。在非霍奇金淋巴瘤的多种类型中,有一种亚型叫做皮肤 T 细胞淋巴瘤(cutaneous T-cell lymphoma,CTCL),其中 MF 与 SS 是 CTCL 最为常见的两种类型,它们占所有淋巴瘤病例的不到 5%。
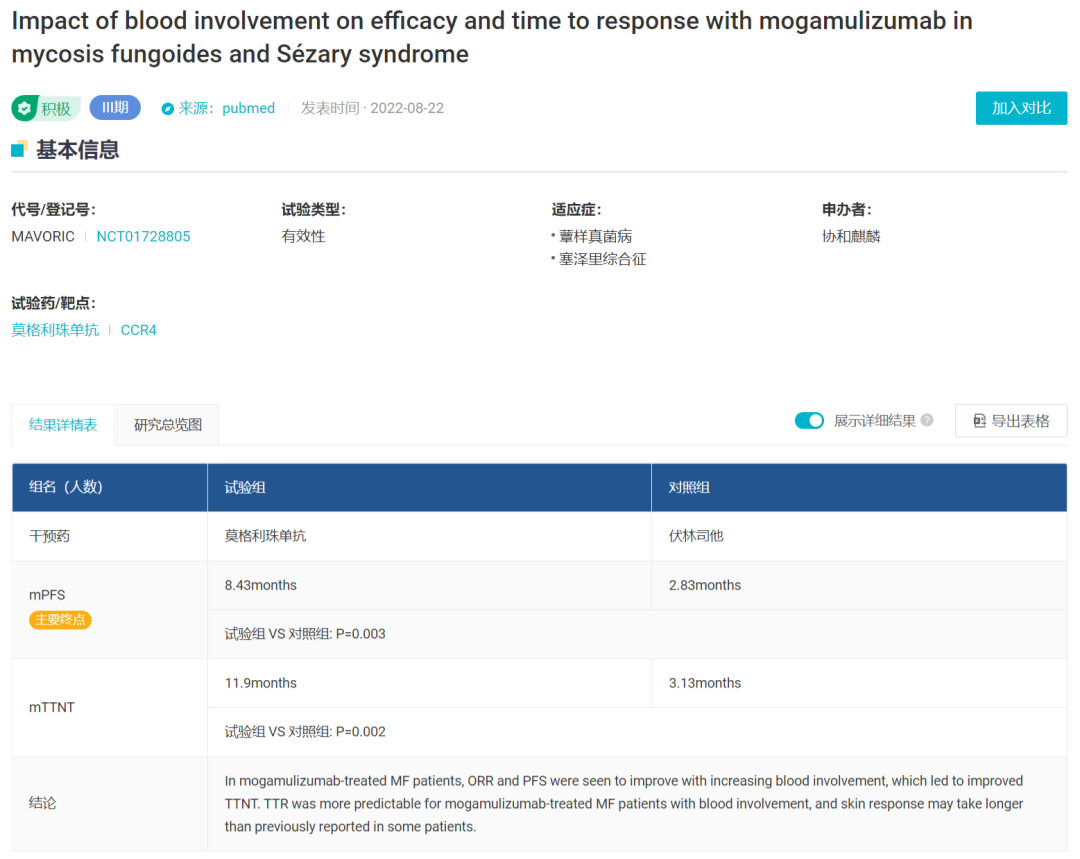
一项代号为 MAVORIC 的 Ⅲ 期临床研究中,372 例 CTCL 患者按 1:1 分为 Moga 组和 Vorinostat 组,这些患者至少经过一次系统治疗的 CTCL (MF,SS)。
结果显示:Moga 组 ORR 为 28%,Vorinostat 组 ORR 为 4.8%,(P<0.0001)。结论显示,在既往接受治疗的皮肤型 T 细胞淋巴瘤(CTCL)患者中,莫利珠单抗与伏立诺他相比,前者显著改善了 PFS。而据 2022 年更新发表的结果显示,Moga 组的 mPFS 为 8.43 个月, Vorinostat 组则仅为 2.83 个月,P=0.003。
MAVORIC 临床试验结果(Insight)
来自:Insight 数据库网页版
新适应症获批上市
基石药业:RET 抑制剂一线 NSCLC 报上市
10 月 13 日,据 CDE 官网显示,基石药业普拉替尼胶囊新适应症申报上市,用于一线治疗局部晚期或转移性 RET 融合阳性 NSCLC 患者(受理号:JXHS2200094)。
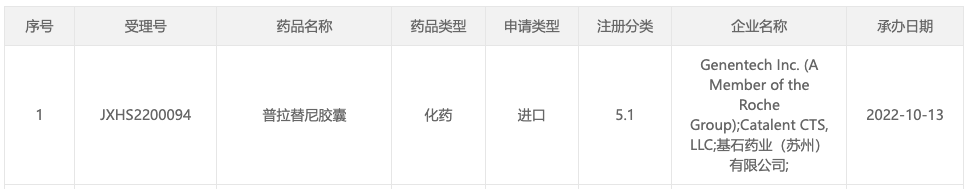
来自:CDE 官网
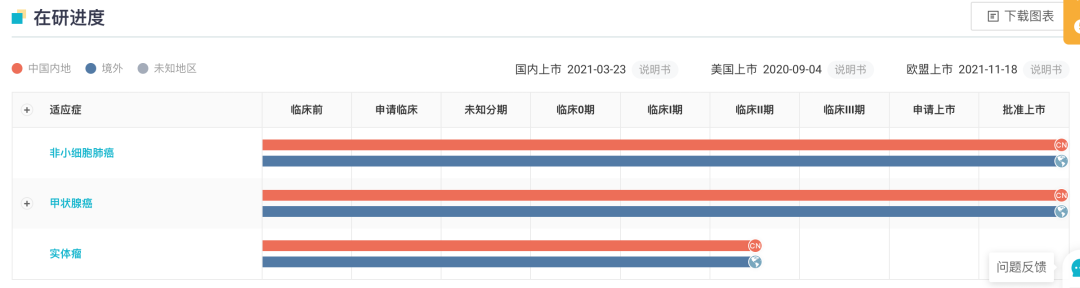
普拉替尼/Pralsetinib 是一种口服(每日一次)、高效和高选择性 RET 抑制剂。据 Insight 数据库显示,普拉替尼最早于美国获批上市,用于治疗非小细胞肺癌,此后拓展适应症至甲状腺髓样癌及甲状腺癌。
普拉替尼全球项目开发进度
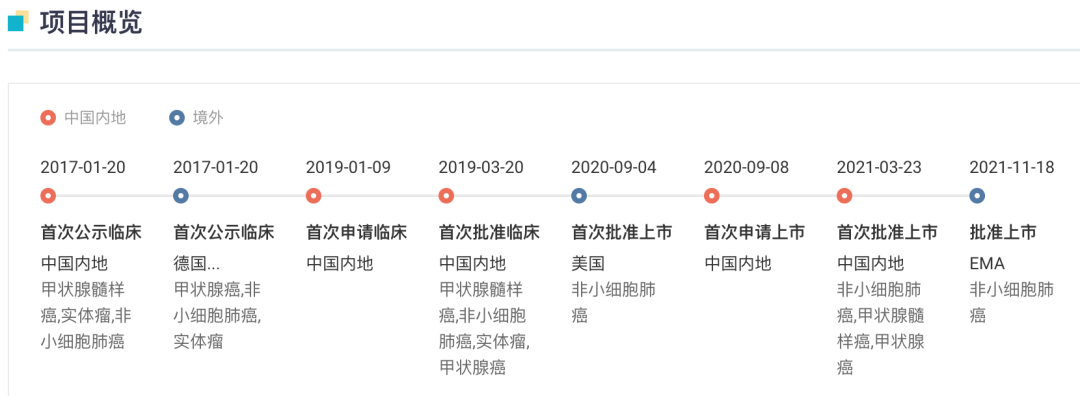
来自:Insight 数据库 网页版(http://db.dxy.cn/v5/home/)
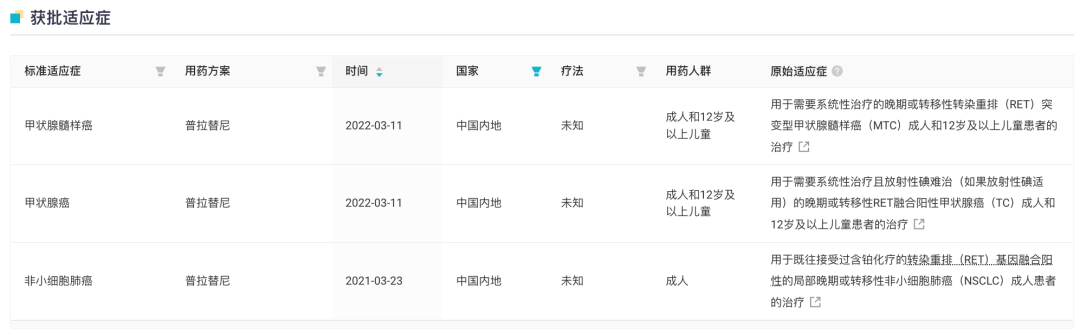
在国内,普拉替尼已获批 3 项适应症:
2021 年 3 月普拉替尼在国内首次获批,用于既往接受过含铂化疗的转染重排(RET)基因融合阳性的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者的治疗,成为国内首个批准上市的高选择性 RET 抑制剂。
今年 3 月普拉替尼再次获批新适应症,用于需要系统性治疗的晚期或转移性 RET 突变型甲状腺髓样癌(MTC)成人和 12 岁及以上儿童患者的治疗,以及需要系统性治疗且放射性碘难治(如果放射性碘适用)的晚期或转移性 RET 融合阳性甲状腺癌成人和 12 岁及以上儿童患者的治疗。
普拉替尼胶囊获批适应症
来自:Insight 数据库网页版
而本次基石药业再次申报新适应症用于一线治疗局部晚期或转移性 RET 融合阳性 NSCLC 患者。
此前基石药业在 2021 ASCO 年会上披露了一项 I/II 期 ARROW 研究中全球 RET 融合阳性 NSCLC 患者的试验结果。结果显示,截至 2020 年 11 月的数据,在接受起始剂量 400 mg 每日一次的疗效可评估的 RET 融合阳性 NSCLC 患者中,普拉替尼具有持久的临床获益。
在 68 例未经系统性治疗的患者中,总体缓解率(ORR)为 79%(95% CI:68%、88%)。完全缓解率(CR)为 6%,10% 患者的靶病灶完全消失,74% 的患者为部分缓解(PR)。中位缓解持续时间(DOR)尚未达到(95% CI:9.0 个月,未达到)。
而在 126 例既往接受过含铂化疗的患者中,ORR 为 62%(95% CI:53%、70%)。CR 率为 4%,12% 患者的靶病灶完全消失,58% 的患者达到 PR。中位 DOR 为 22.3 个月(95% CI:15.1 个月,未达到)。
在安全性方面,最常见的不良事件(AE)是中性粒细胞减少、天冬氨酸氨基转移酶升高、贫血、白细胞计数减少、丙氨酸氨基转移酶升高、高血压、便秘和乏力。
作为国内首款高选择性 RET 抑制剂,普拉替尼表现出强劲的市场潜力。在国内上市一个月内便已覆盖约 70 个城市的 80 家 DTP 药房。据基石药业财报,2021 年,普拉替尼和另一款精准治疗药物泰吉华共同实现了超 1.6 亿元的销售额。
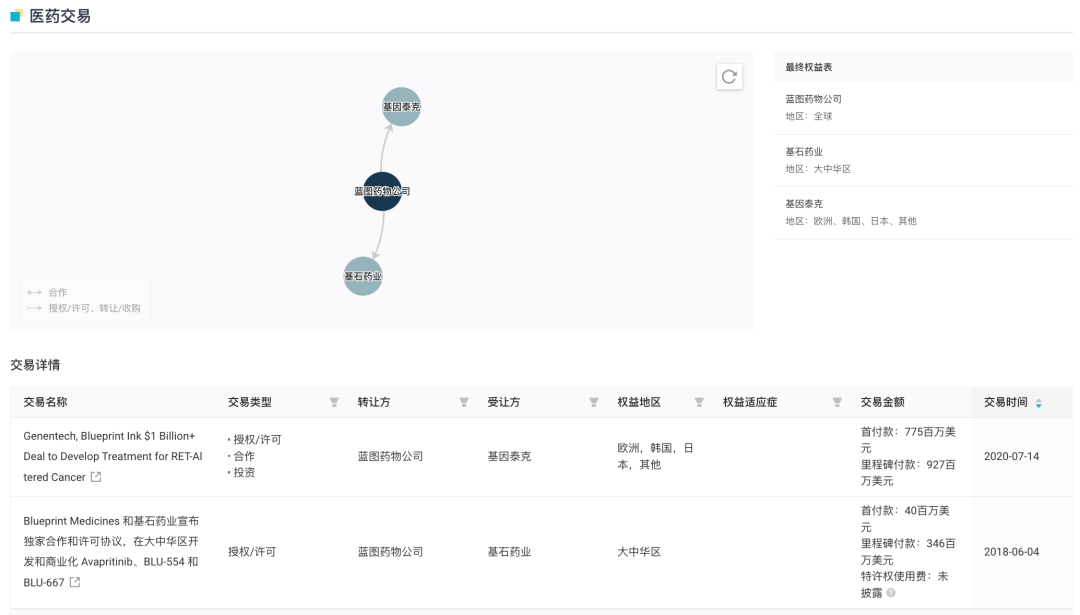
普拉替尼最早由 Blueprint Medicines 公司开发,2018 年 6 月,基石药业与 Blueprint Medicines 公司达成了独家合作和许可协议,获得了普拉替尼在大中华地区的独家开发和商业化权利。值得一提的是,普拉替尼同时也吸引了罗氏的目光。2020 年 7 月,罗氏与 Blueprint Medicines 签订了一项 17 亿美元的许可及合作协议,获得了普拉替尼在美国以外地区(不包括大中华区)的独家权利以及美国市场的联合商业化权利。目前普拉替尼已在欧洲获批上市。
Pralsetinib 医药交易
来自:Insight 数据库网页版
对于高选择性 RET 抑制剂早有多家企业布局,这其中就包括礼来。礼来塞普替尼/Selpercatinib 为全球首款高选择性 RET 抑制剂,近日该药物也刚在国内获批上市,详见往期文章>>>礼来高选择性 RET 抑制剂塞普替尼在中国获批上市
首次申报上市
科济药业:BCMA CAR-T 疗法拟纳入优先审评
10 月 13 日,据 CDE 官网显示,拟将科济药业 BCMA CAR-T 疗法泽沃基奥仑赛注射液纳入优先审评,用于既往接受过至少一种免疫调节剂和蛋白酶体抑制剂治疗失败的复发或难治性多发性骨髓瘤成年患者。

来自:CDE 官网
泽沃基奥仑赛(Zevor-cel/CT053)是科济生物开发的全人抗 BCMA 的 CAR-T 细胞产品,用于治疗多发性骨髓瘤。此前该药已获得多项认可:2019 年 8 月获美国 FDA 授予孤儿药称号;2019 年 9 月及 2020 年 4 月分别获获欧洲药品管理局(EMA)授予优先药物(PRIME)资格及孤儿药称号;2020 年 12 月,被 NMPA 纳入突破性治疗品种。
科济药业曾在第七届 CAR-TCR 年度峰会上披露了泽沃基奥仑赛注射液北美 II 期临床试验数据。这是一项多中心、开放标签的 1b/2 期试验 (登记号:NCT03915184) ,旨在评估该产品在北美复发╱难治多发性骨髓瘤 (R/R MM) 患者中的安全性和有效性。主要研究终点为治疗相关不良事件(TRAE)的发生率、最大耐受剂量(DLT)和客观缓解率(ORR)。
截至 2022 年 8 月 31 日,共有 17 名患者在该项试验中接受 zevor-cel 输注,且中位随访为 113 天。结果显示:
在有效性方面,在 11 名至少 8 周随访的可评估的患者中,4 例患者伴随 EMD,客观缓解率为 100% (非常好的部分缓解、完全缓解或严格完全缓解),并在更长时间的随访观察到更深的缓解。由于所有的缓解都在进行中,中位无进展生存期、中位生存期和中位缓解持续时间尚未达到,并且完全缓解╱严格完全缓解率尚未成熟。所有的在第四周有 MRD 结果的患者通过二代测序 MRD 均为阴性。
在安全性方面,没有出现死亡,以及没有患者经历过 3 级或者更高的细胞因子释放综合症。在 10/17(59%) 名患者中观察到细胞因子释放综合症,均为 1 级或者 2 级。有一例短暂的 3 级免疫效应细胞相关神经毒性综合症被报导且该病人已完全恢复;没有神经毒性且没有观察到具有帕金森特症。在毒性的处理方面,仅 5/17(29%)名患者接受托珠单抗治疗,仅 1 名(5.9%)患者接受糖皮质激素治疗。
NCT03915184 临床试验结果

来自:Insight 数据库网页版
新适应症申报上市
复星凯特:阿基仑赛注射液新适应症报上市,并拟优先审评
10 月 14 日,据 CDE 官网显示,拟将复星凯特的阿基仑赛注射液纳入优先审评,用于一线免疫化疗无效或在一线免疫化疗后 12 个月内复发的成人大 B 细胞淋巴瘤(r/r LBCL)。
来自:CDE 官网
阿基仑赛注射液是复星凯特 2017 年初从美国 Kite(吉利德旗下公司)引进 Yescarta (axicabtagene ciloleucel) 在中国进行技术转移,并获授权在中国进行本地化生产的靶向人 CD19 自体 CAR-T 细胞治疗产品。
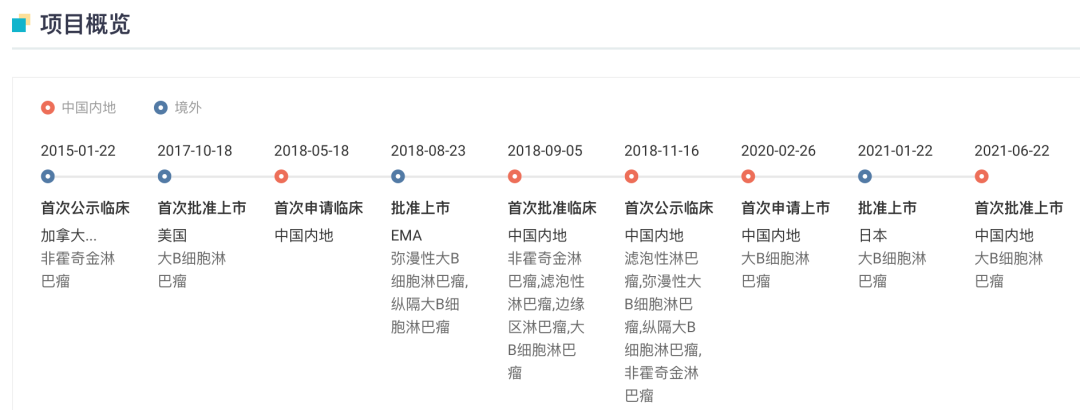
据 Insight 数据库显示,Yescarta 早于 2017 年 10 月获 FDA 批准上市,用于三线及三线以上治疗 LBCL 成年患者,是美国 FDA 批准的首款针对特定非霍奇金淋巴瘤的 CAR-T 细胞药物。
Yescarta 全球项目开发关键节点
来自:Insight 数据库网页版
2021 年 3 月,其用于治疗复发/难治性滤泡性淋巴瘤(FL)成人患者的扩展适应症申请获得美国 FDA 加速批准,成为全球首个获批上市用于 FL 的 CAR-T 细胞治疗产品。
今年 4 月,Yescarta 进一步拓展新适应症,获批用于二线大 B 细胞淋巴瘤治疗,成为全球首款获 FDA 批准作为二线疗法的 CAR-T 药物。
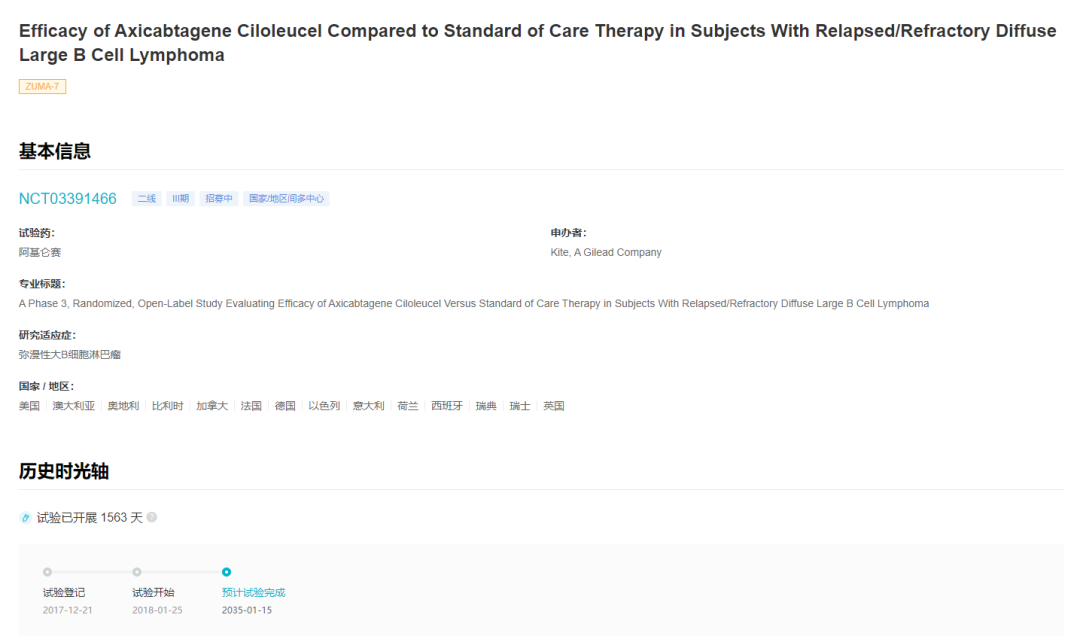
此次适应症的获批是基于 ZUMA-7 研究(登记号:NCT03391466)的试验结果。ZUMA-7 研究于 2017 年启动,是首个也是规模最大的 CAR-T 细胞疗法用于二线治疗 R/R LBCL 的 3 期随机研究,在全球 77 个中心招募了 359 名患者。
ZUMA-7 试验登记情况
来自:Insight 数据库 (http://db.dxy.cn/v5/home/)
此前吉利德曾披露了此项临床试验数据,并同步发表于 NEJM。
中位随访超过两年,该研究达到了无事件生存的主要终点(EFS;风险比 0.398;95% CI:0.308-0.514,P<0.0001)。较之标准疗法(SOC),Yescarta 治疗组两年后存活且不需要额外癌症治疗或发生癌症进展的患者增加了 2.5 倍(40.5% 与 16.3%),中位 EFS 增加了四倍(8.3 个月与2.0 个月)。
NCT03391466 临床试验结果

来自:Insight 数据库网页版
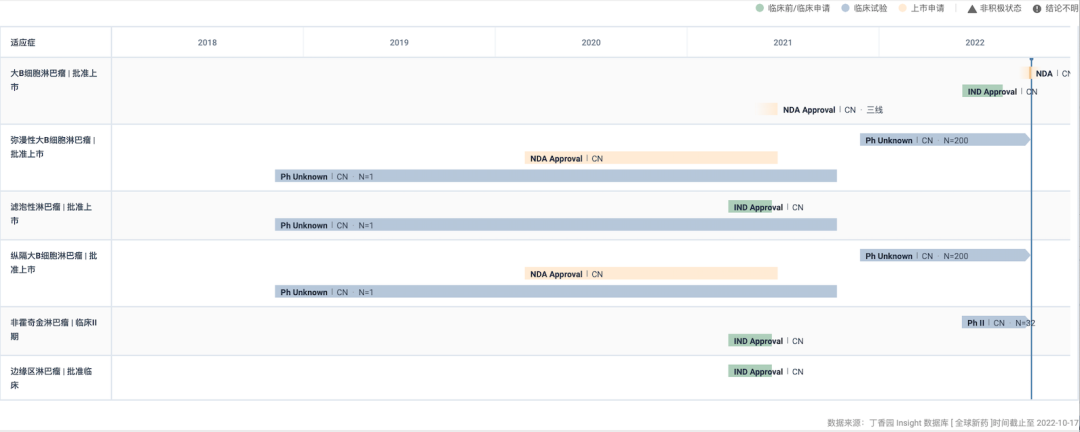
在国内,阿基仑赛于 2021 年 6 月获批上市(点此回顾审评历程),用于治疗既往接受二线或以上系统性治疗后复发或难治性大B细胞淋巴瘤成人患者,成为国内首款获批的 CAR-T 疗法,开启了国内细胞治疗元年。
此后,于 2021 年 8 月,其新增适应症纳入突破性治疗药物程序,拟用于治疗接受过二线或以上系统性治疗后复发或难治性惰性非霍奇金淋巴瘤(r/r iNHL),包含滤泡性淋巴瘤(FL)和边缘区淋巴瘤(MZL)。
本周,CDE 官网公示其申报上市新适应证并拟纳入优先审评,用于二线大 B 细胞淋巴瘤。
阿基仑赛国内开发进度甘特图
来自:Insight 数据库网页版
临床结果积极
百济:泽布替尼全球 3 期头对头研究达到 PFS 优效性
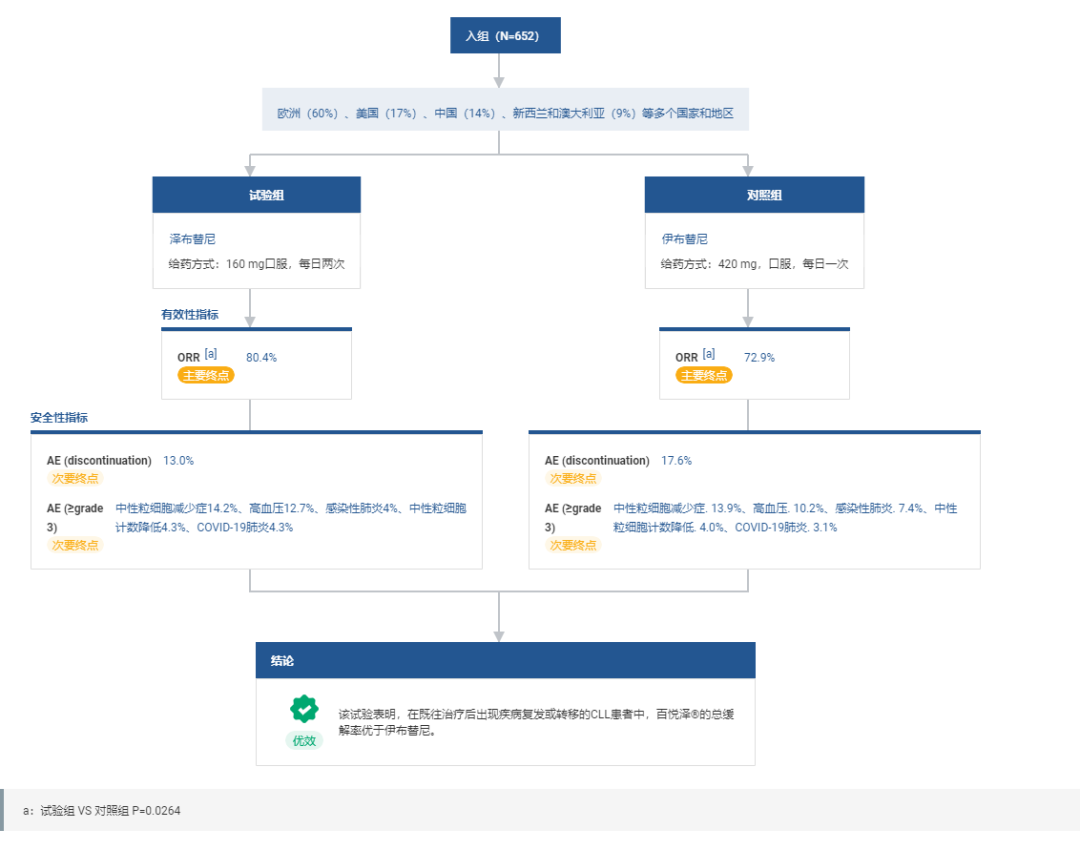
10 月 12 日,百济神州宣布,在全球 3 期头对头 ALPINE 试验的终期分析中,经独立评审委员会(IRC)及研究者评估,百悦泽®(泽布替尼)对比亿珂®(伊布替尼),达到无进展生存期(PFS)的优效性结果。泽布替尼总体耐受性良好,本次分析显示的安全性结果与既往报告中一致。
由此,泽布替尼成为全球首个且唯一在慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤(SLL)中,「头对头」对比伊布替尼,在 PFS 方面达到优效性的 BTK 抑制剂。
PFS 是 CLL 治疗中的重要指标之一,在评估患者长期治疗的疗效和生活质量方面具有参考意义。此次 ALPINE 研究在 PFS 终期分析中取得积极结果,也再次印证了泽布替尼作为「同类最优」药物的治疗潜力。据介绍,本次 PFS 终期分析的详尽数据将在未来的相关专业文献以及医学大会上进一步公布。
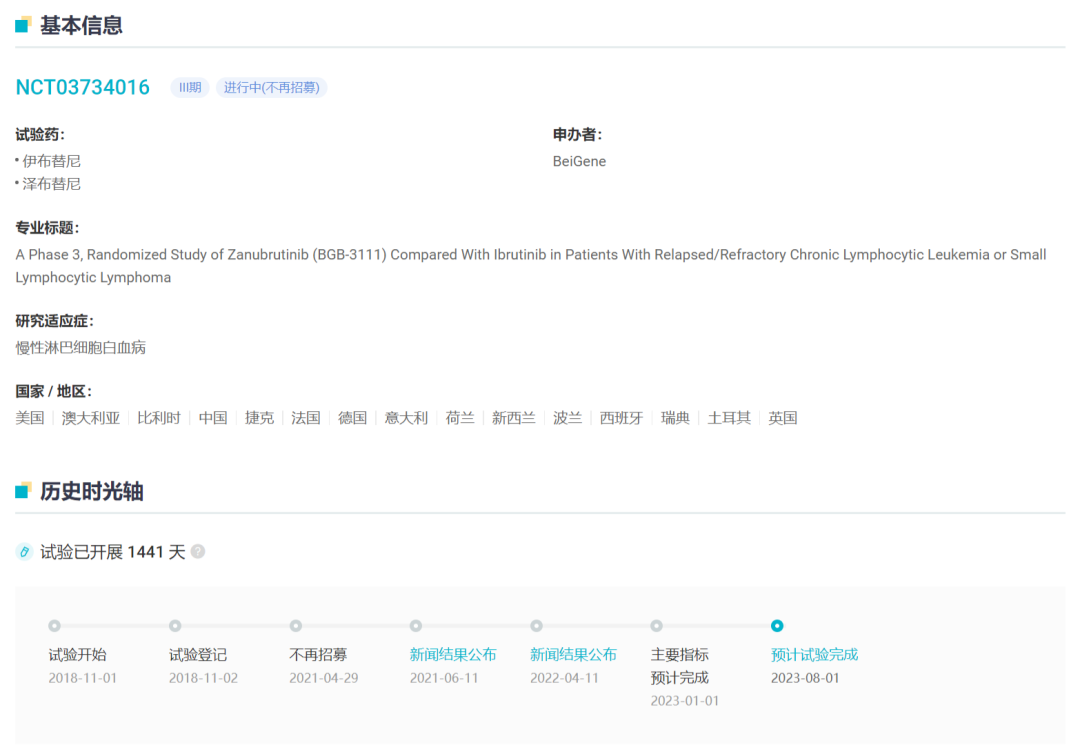
作为泽布替尼的三项重磅全球 3 期临床试验之一,ALPINE 研究启动于 2018 年,这项随机性、全球多中心的临床研究,旨在评估泽布替尼对比伊布替尼,用于复发或难治性(R/R)CLL/SLL 患者的效果。
值得一提的是,研究共在全球范围入组了 652 例患者,其中 60% 患者来自欧洲,17% 在美国,14% 在中国,9% 在新西兰和澳大利亚,从而确保了试验在不同人种、地域间的多样性。
ALPINE 研究基本信息
来源:Insight 数据库网页版
ALPINE 研究的主要终点为 ORR,经研究者和 IRC 评估的 ORR 采用预先规定的分级评估检验,首先评估非劣效性,随后评估优效性。研究的关键次要终点包括 PFS 和房颤或房扑事件发生率;其他次要终点包括持续缓解时间(DoR)、总生存期(OS)以及不良事件发生率。
今年 4 月,百济神州公布了 ALPINE 研究的最终缓解评估结果,经 IRC 确认,泽布替尼在治疗 R/R CLL/SLL 患者中,取得了优于伊布替尼的 ORR。同时,泽布替尼在房颤等关键安全性指标中也展现出了更高的安全性和耐受性。
ALPINE 研究最终缓解评估结果
截图来自:Insight 数据库网页版
而此次公布的 PFS 最终分析结果,则在长期疗效指标上,进一步验证了泽布替尼的治疗获益。
PFS 通常代表患者从随机分组到发生疾病进展或因任何原因死亡的时间, 也是 CLL 治疗中的重要指标之一。CLL 作为一类进展相对缓慢的血液恶性肿瘤,患者在长期治疗中的疗效和生活质量,在临床中引起了高度关注。
此次 ALPINE 研究在 PFS 终期分析中取得积极结果,也再次印证了泽布替尼作为「同类最优」药物的治疗潜力。据介绍,本次 PFS 终期分析的详尽数据将在未来的相关专业文献以及医学大会上进一步公布。
首次启动临床
1、恒瑞:特发性肺纤维化新药启动临床
10 月 11 日,据 Insight 数据库显示,恒瑞 HRG2101 吸入剂启动 I 期临床(登记号:CTR20222609)。

来自:Insight 数据库网页版
据 Insight 数据库显示, HRG2101 于今年 6 月首次申报临床,并于 8 月首次获批临床,用于治疗特发性肺纤维化。
HRG2101 国内项目开发进度

来自:Insight 数据库网页版
HRG2101 通过调节或抑制 TGF-β1 等细胞因子,抑制成纤维细胞的生物学活性,减少细胞增殖和基质胶原合成;同时,还可抑制 TNF-α 等炎性介质分泌、减少脂质过氧化等,发挥其抗炎和抗氧化作用。截至 9 月 1 日,HRG2101 吸入剂相关项目累计已投入研发费用约 1154 万元。
首次申报临床
先声药业:2 款抗体新药首次申报临床
10 月 10 日,先声药业的两款生物新药首次申报临床:TIGIT/PVRIG 双特异性抗体 SIM0348,和 PD-L1/IL15v 双功能融合蛋白 SIM0237。
从药物类别来说,SIM0348 是先声申报的首款双抗,SIM0237 也是首款双功能融合蛋白,因此本次申报也意味着该公司在创新药研发上又迈出了新的一步。
先声药业此前曾在投资者会议上介绍了这两款新药的作用机制、潜在优势和临床前数据。SIM0348 同时靶向 TIGIT 和 PVRIG 两个免疫检查点,优化了 Fc 功能,提高了对 Treg 细胞的杀伤效率。

来自:先声药业官方资料,下同
在 PD-L1 抑制剂非敏感的细胞模型中,SIM0348 组观察到了超过 50% 的肿瘤生长抑制,并展现出与 PD-L1 抑制剂阿替利珠单抗(Tecentriq®)的协同作用。
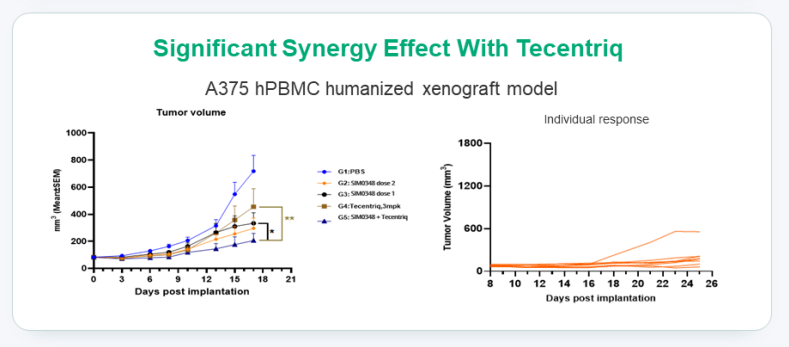
值得一提的是,相较于 TIGIT 单抗 Tiragolumab,对 PVRIG 的靶向使 SIM0348 在单药情况下也具有不错的肿瘤抑制活性,且相较于单抗联用,潜在具有 1+1 >2 的疗效优势。
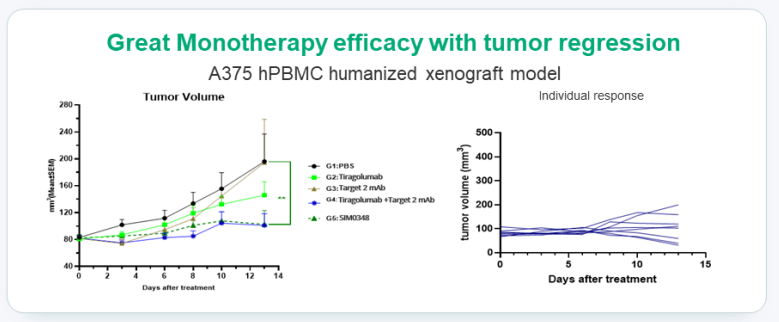
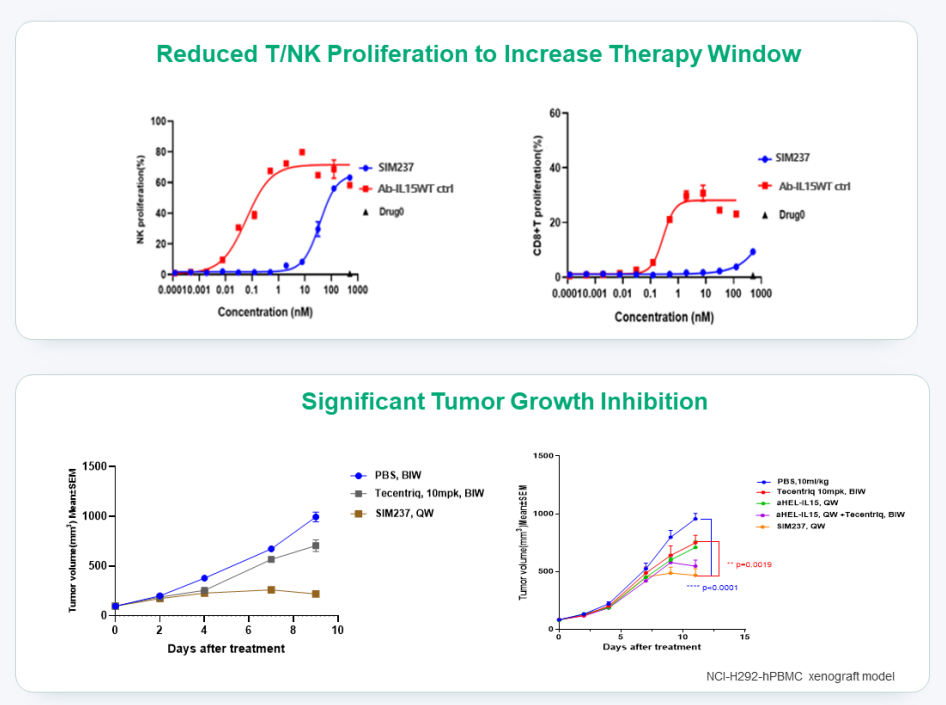
SIM0237 则是一款潜在 Best-in-class PD-L1/IL15v 双功能融合蛋白,具有更高的活性和更低的安全风险。该药可阻断 PD-1/PD-L1 信号通路,将 IL-15 直接递送至肿瘤微环境以完全激活 CD8 T 细胞。
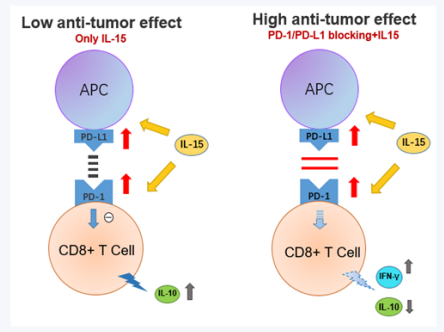
SIM237 通过降低 T/NK 增殖改善了治疗窗,拥有更好的安全模式,且在临床前细胞模型中相较于 Tecentriq 表现出更高的肿瘤抑制活性。
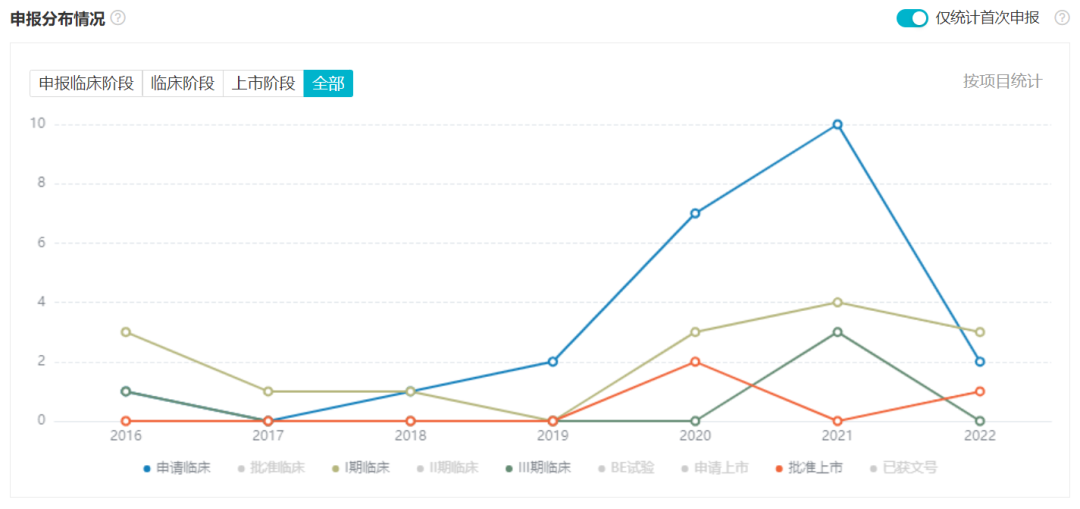
据 Insight 数据库显示,先声药业自 2020 年以来,新药研发也是进入了爆发期。尤其在 2021 年度,先声药业有 10 个创新药首次进入临床。治疗领域除了实体瘤和心血管领域之外,还新进入了阿尔茨海默病领域。
先声药业近 7 年新药开发趋势
来源:Insight 数据库网页版
* 数据筛选说明:按「先声药业」最高母企业,统计化药原研药和生物药原研药(不包括改良新和类似药),仅统计首次进展至各阶段的项目。

境外创新药进展
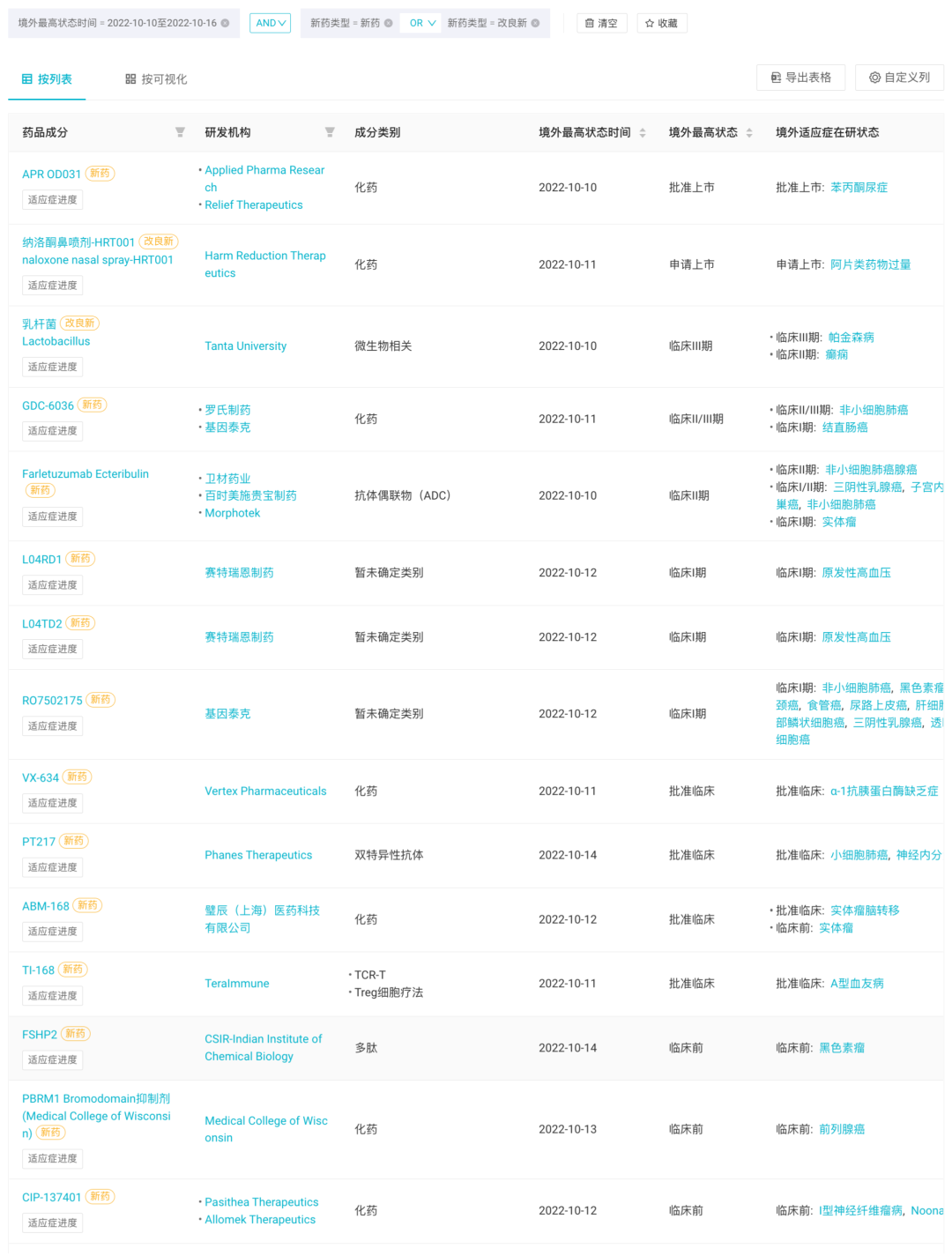
本周境外共有 15 款新药(含改良新)研发进度推进到新阶段。其中,默沙东、葛兰素史克等 MNC 均有相关临床结果动态。
本周境外 15 款新药(含改良新)动态
1、默沙东:肺动脉高压药关键 III 期临床结果积极







 个人中心
个人中心
 我是园区
我是园区




